某河道两旁有甲乙两厂。它们排放的工业废水中,共含K十、Ag十、Fe3+、C1-、OH-、NO3--六种离子。甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子_______、_______、_______。
乙厂的废水中含有另外三种离子。如果加一定量_______(选填:活性炭、硫酸亚铁、铁粉)。可以回收其中的金属_______(填写金属元素符号)。
另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的_______(填写离子符号)转化为沉淀。经过滤后的废水主要含_______,可用来浇灌农田。
煤炭是我国的主要能源之一,与之伴生的二氧化硫(SO2)和酸雨污染问题较为突出。目前我国采用的控制方法是电厂烟气脱硫。烟气脱硫的原理是利用碱性物质吸收并固定酸性的二氧化硫,主要有如下两种方法:
I、钠碱循环法脱硫技术。
(1)此法是利用Na2SO3溶液可脱除烟气中的SO2。Na2SO3可由NaOH溶液吸收SO2制得,该反应的离子方程式: 。
(2)NaOH溶液吸收SO的过程中,pH随 变化关系如下表:
变化关系如下表:
①由上表判断,NaHSO3溶液显 性,用化学平衡原理解释: 。
②当溶液呈中性时,离子浓度关系正确的是(选填字母): 。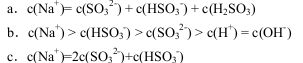
II、石灰石脱硫法
此法是以石灰石为原料通过系列反应将硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4 (s)+ CO (g) CaO(s)+ SO2 (g)+ CO2 (g) △H=218.4kJ·mol-1(反应Ⅰ)
CaO(s)+ SO2 (g)+ CO2 (g) △H=218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) CaS(s)+ 4CO2(g) △H2= -175.6kJ·mol-1 (反应Ⅱ)
CaS(s)+ 4CO2(g) △H2= -175.6kJ·mol-1 (反应Ⅱ)
请回答下列问题:
(1)结合反应Ⅰ、Ⅱ写出CaSO4(s)与CaS(s)的热化学反应方程式 。
(2)对于气体参与的反应,表示平衡常数 Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅰ的Kp= (用表达式表示)。
(3)假设某温度下,反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是 。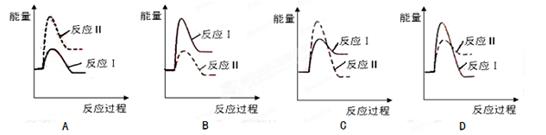
(4)图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数 的关系曲线。则降低该反应体系中产生的SO2生成量的措施有 。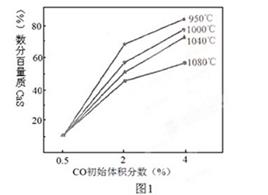
A、向该反应体系中投入生石灰
B、在合适的温度区间内控制较低的反应温度
C、降低CO的初始体积百分数
D、提高反应体系的温度
下面是元素周期表的一部分,参照元素①-⑧在表中的位置,请用化学用语回答下列问题: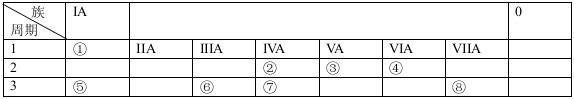
(1)④、⑤、⑦的原子半径由大到小的顺序为(元素符号)____________ ____。
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是(填化学式)_______。
(3)在①、④、⑤、⑧中的某些元素之间可形成既含离子键又含非极性共价键的离子化合物,写出其中一种化合物的电子式:_______________。
(4)由②和④组成的化合物与⑤的同周期相邻主族元素的单质反应的化学方程式为:_______。
(5)⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为 。
(6)常温下,由①②④组成最简单的液态有机物可作为燃料电池的原料之一,请写出其在碱性介质中的电极反应式: 。
原子序数依次增大的短周期元素a、b、c、d和e中,a的最外层电子数为其周期数的二倍;b和d的A2B型氢化物均为V形分子,c的+1价离子比e的-1价离子少8个电子。
回答下列问题:
(1)元素c为________;d为_______。
(2)由这些元素形成的双原子分子为__________________。
(3)这些元素的单质或由它们形成的AB型化合物中,其晶体类型属于原子晶体的是_______,离子晶体的是_______,金属晶体的是_______,分子晶体的是_______(每空填一种)。
(4)元素a和b形成的一种化合物与c和b形成的一种化合物发生的反应常用于防毒面具中,两种化合物的电子式分别为: 、 ,该反应的化学方程式为:______ _。
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;元素B的氢化物能用于刻蚀玻璃; C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的核外电子排布式是___________,A、B、C、D的第一电离能由小到大的顺序为__________。
(2)化合物CA的熔点远高于C的氯化物的熔点,理由是______________;
(3)A的最高价含氧酸根离子中,其中心原子采取_____杂化,D的低价氧化物分子的空间构型是_______。
(4)B2与NaOH溶液反应的产物之一是OB2,该反应的离子方程式为__________。
接触法制硫酸采用V2O5作催化剂,使用过的催化剂中含V2O5、VOSO4和SiO2,其中VOSO4能溶于水,从使用过的V2O5催化剂中回收V2O5的主要步骤是:向使用过的催化剂中加硫酸和Na2SO3浸取还原,过滤得VOSO4溶液;向滤液中加入KClO3氧化,再加入氨水生成沉淀;将沉淀焙烧处理后得V2O5。
(1)V2O5被浸取还原的反应产物之一是VOSO4,该反应的化学方程式为____。
(2)若生产过程使用的硫酸用量过大,进一步处理时会增加________的用量。氨气常用________检验,现象是________________。
(3)若取加入氨水后生成的沉淀(其摩尔质量为598 g·mol-1,且仅含有四种元素)59.8 g充分焙烧,得到固体残留物54.6 g,同时将产生的气体通过足量碱石灰,气体减少了1.8 g,剩余的气体再通入稀硫酸则被完全吸收。通过计算确定沉淀的化学式_____________ (写出计算过程)。