一定条件下,体积为10L的密闭容器中,1和1进行反应:
2(g)+(g)  (g),经60s达到平衡,生成0.3。下列说法正确的是()
(g),经60s达到平衡,生成0.3。下列说法正确的是()
| A. | 以X浓度变化表示的反应速率为0.001 |
| B. |
将容器体积变为20L,Z的平衡浓度变为原来的
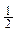
|
| C. | 若增大压强,则物质Y的转化率减小 |
| D. | 若升高温度,X的体积分数增大,则该反应的△H>0 |
在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应:A(s)+2B(g) C(g)+D(g)已达平衡的标志是()
C(g)+D(g)已达平衡的标志是()
| A.混合气体的压强 | B.混合气体的密度 |
| C.B的物质的量浓度 | D.混合气体的总物质的量 |
在N2(g)+3H2(g) 2NH3(g)的平衡体系中,其他条件不变,增大氮气的浓度,下列判断正确的是()
2NH3(g)的平衡体系中,其他条件不变,增大氮气的浓度,下列判断正确的是()
| A.氮气的转化率增大 | B.氢气的转化率增大 |
| C.氨气在平衡混合气体中的含量一定增大 | D.氨气在平衡混合气体中的物质的量增多 |
对可逆反应2SO2(g)+O2(g) 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是()
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是()
| A.增大压强 | B.升高温度 | C.使用催化剂 | D.多充入O2 |
在A+B C(正反应是放热反应)中,如下图,能正确表示反应速率(纵坐标)与温度(横坐标)关系的是( )
C(正反应是放热反应)中,如下图,能正确表示反应速率(纵坐标)与温度(横坐标)关系的是( )
可逆反应N2(g)+3H2(g) 2NH3(g),500 ℃时在容积为10 L的密闭容器中进行,开始时加入2 mol N2和2 mol H2,则达到平衡时,NH3的浓度不可能达到()
2NH3(g),500 ℃时在容积为10 L的密闭容器中进行,开始时加入2 mol N2和2 mol H2,则达到平衡时,NH3的浓度不可能达到()
| A.0.1 mol·L-1 | B.0.2 mol·L-1 | C.0.05 mol·L-1 | D.0.15 mol·L-1 |