实验室中用浓盐酸与MnO2制取Cl2,再用Cl2和Ca(OH)2反应制少量漂白粉。已知Cl2和Ca(OH)2制漂白粉是放热反应,温度稍高易发生副反应:
6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。现有三位同学分别设计的三套实验装置如下(U形管中放有玻璃纤维,气体能顺利通过):
(1)请从以下六方面对上述甲、乙、丙三套装置的优缺点进行评价,将适当的选项序号填于下表内:
a.不易控制反应速率 b.容易控制反应速率 c.有副反应发生
d.可防止副反应发生 e.容易污染环境 f.可防止污染环境
| |
优点 |
缺点 |
| 甲装置 |
|
|
| 乙装置 |
|
|
| 丙装置 |
|
|
(2)请从甲、乙、丙三套装置中,选取合理的组成部分(A、B、C、D、E、F、G),组装一套你认为更完善的实验装置,连接顺序(按气流从左到右的方向)为 ;在此装置及甲、乙、丙三装置中,你认为是否还缺少必要的装置,并说明原因
。
(3)如果反应前加入了m g Ca(OH)2,反应结束并冷却后倒出固体物质称量为n g(设反应中产生的水仍留在固体物质中)。则该固体物质中Ca(ClO)2的质量分数的表达式为(不必化简): 。
(本题共12分)如下图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、锌粒、稀盐酸、二氧化锰、氯化铵、熟石灰。现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答以下问题:
(1)选用A装置可制取的气体有________;选用B装置可制取的气体有________;通常选用C装置制取的气体有________。
(2)标号为①、②的仪器名称依次是________、______________。
(3)写出利用上述有关药品制取Cl2的离子方程式:_______________________________。
(本题共18分)配制480 mL 0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)选择仪器:完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、________、________等。
(2)计算、称量:需称量NaOH固体的质量为________。
(3)溶解、冷却,该步实验中需要使用玻璃棒,作用是___________________。
(4)转移、洗涤。洗涤烧杯2~3次是为了______________________________。
(5)定容、摇匀。定容的具体操作是___________________________________。
(6)不规范的实验操作会导致实验结果的误差,下列使所配溶液的物质的量浓度偏高的是 ,偏低的是 ,无影响的是 (填字母序号)。
| A.容量瓶洗净后未烘干; |
| B.在溶解过程中有少量液体溅出烧杯外 |
| C.定容时俯视刻度线; |
| D.将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容 |
E、定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线
[化学]三氧化二铁和氧化亚铜是红色粉末,常作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设 l:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是__
(2)若滴入 KSCN溶液后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?_____________。筒述你的理由
(3)若固体粉末完全溶解无固体存在,滴加KSCN溶液时溶液不变红色,则证明原固体粉末是Fe2O3和Cu2O的混合物,则其质量比为__ _,写出其中发生的氧化还原反应的离子方程式 。探究延伸:经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg ,则混合物中Cu2O的质量分数为 。
,则混合物中Cu2O的质量分数为 。
为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
请回答:
(1)写出步骤Ⅰ反应的离子方程式: 。
(2)试剂X是 。步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是 。
(3)进行步骤Ⅱ时,该小组用如图所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 。
(4)用固体F制备CuSO4溶液,可设计以下三种途径:
写出途径①中反应的离子方程式 ,
请选出你认为的最佳途径 说明选择的理由 。
在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~100nm之间)。下图所示A-E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。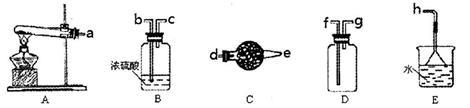
(1)实验室制取、收集干燥的NH3,需选用上述仪器装置的接口连接顺序是(选填字母):a接_________,_________接_________,_________接h;用A装置制取NH3的化学反应方程式为 .
(2)用图所示装置也可以制取NH3,则圆底烧瓶中的固体可以选用_________ (选填字母编号);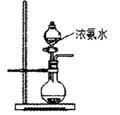
| A.碱石灰 |
| B.生石灰 |
| C.无水氯化钙 |
| D.无水硫酸铜 |
E.烧碱
(3)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是_________,试写出制纳米级碳酸钙的化学方程式__________________;
(4)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级 。