(1)实验室常用的浓盐酸密度为1.17g/mL、质量分数为36.5%。此浓盐酸的物质的量浓度为 mol/L。取此浓盐酸43mL,用蒸馏水稀释至200mL,稀盐酸的物质的量浓度为 mol/L。
(2) 4.8g镁投入此200mL稀盐酸中,反应后,求:
①放出的H2在标准状况下的体积。
②将生成的H2通过过量的灼热CuO,求被还原出的铜的质量。
③反应后(设溶液体积不变)溶液中两种阳离子的物质的量浓度之比。
为了预防碘缺乏病,国家规定每千克食盐中应含有40~50 mg的碘酸钾。为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428 g,设法溶解出其中全部的碘酸钾。将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.030 mol·L-1的硫代硫酸钠溶液滴定,用去18.00 mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品。有关反应如下: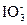 +5I-+6H+
+5I-+6H+ 3I2+3H2O
3I2+3H2O
I2+2S2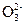
 2I-+S4
2I-+S4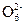
将6.38 g NaNO3、NaCl、Na2CO3的混合物溶于水,向其中滴加34.7 mL 1.00 mol·L-1 AgNO3溶液后,不再有沉淀生成。过滤后,使沉淀与足量稀硝酸作用,产生135 mL(标准状况)气体。计算原混合物中NaCl的质量分数。
在1.00 L 1.00 mol·L-1的NaOH溶液中通过16.8 L(标准状况)CO2,计算所得溶液中含有的NaHCO3和Na2CO3的物质的量。
在一定条件下,16 g A和22 g B恰好反应生成C和4.5 g D。在相同条件下,8 g A和足量的B反应生成D和0.125 mol C。从上述事实可推知C的摩尔质量为。
1.15 g金属钠跟水反应后,得到100 mL溶液,试计算:
(1)生成的气体在标准状况下是多少毫升?
(2)反应后所得溶液的物质的量浓度是多少?