维生素C(又名抗坏血酸,分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可通过在弱酸性溶液中用已知浓度的I2溶液进行测定。该反应的化学方程式如下:C6H8O6+I2 C6H6O6+2HI,现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下。取10 mL 6 mol/L CH3COOH,加入100 mL蒸馏水,将溶液加热煮沸后放置冷却。精确称取0.2000 g样品,溶解于上述冷却的溶液中。加入1 mL淀粉指示剂,立即用浓度为0.05000 mol/L的I2溶液进行滴定,直至溶液中的蓝色持续不褪为止,共消耗21.00 mL I2溶液。
(1)为何加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用?
(2)计算样品中维生素C的质量分数。
在一密闭的2L的容器里充入8mol SO2和4mol 18O2,在一定条件下开始反应:2SO2(g)+O2(g)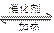 2SO3(g)
2SO3(g)
 2min末测得容器中有7.2mol SO2。
2min末测得容器中有7.2mol SO2。 试回答:
试回答: (1)反应后18O存在哪些物质中 ;
(1)反应后18O存在哪些物质中 ; (2)2min末SO3的浓度;
(2)2min末SO3的浓度; (3)用O2的浓度变化表示该时间段内的化学反应速率。
(3)用O2的浓度变化表示该时间段内的化学反应速率。
把2.5molA和2.5molB混合盛入容积为2L的密闭容器里,发生如下反应:
3A(g) +B(g) x C(g) + 2D(g) , 经5s反应达平衡,在此5s内C的平均反应
x C(g) + 2D(g) , 经5s反应达平衡,在此5s内C的平均反应
速率为0.2mol·L-1·s-1 , 同时生成1molD,试计算:
(1)达到平衡状态时B的转化率?
(2)计算x的值?
(3)达到平衡状态时容器内气体的物质的量是多少?
有机物A由碳、氢、氧三种元素组成。现取2.3 g A与2.8 L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重2.7 g,碱石灰增重2.2 g。回答下列问题:
(1)2.3 g A中所含氢原子、碳原子的物质的量各是多少?
(2)通过计算确定该有机物的分子式。
(3)若该物质能和钠反应产生氢气,试写出该物质的结构简式。
(8分)将6.50g锌投入200mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:
(1)6.50g锌的物质的量;
(2)所用盐酸中HCl中的物质的量浓度;
(3)反应中生成的H2在标准状况下的体积。
某种烃A的蒸气折合成标况下的密度是3.214g/L,已知该烃的碳氢质量比为5∶1,求:
(1)该烃的相对分子质量(2)确定该烃的分子式
(3)如果该烃的一氯取代物有4种,写出该烃的结构简式
(4)烃A可由另一种烃B通过加成反应而制得,则烃B的可能的是(任写一种可能的结构简式)