下图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有ⅥA族和几种元素的位置。请回答下列问题: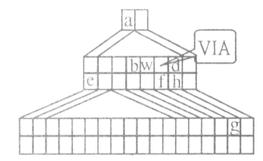
(1)g元素在周期表中的位置 。元素a和w形成的化合物wa3是 分子(填 ”极性”或”非极性”)。
”极性”或”非极性”)。
(2)d的氢 化物的沸点比h的氢
化物的沸点比h的氢 化物的沸点 ,(填”高”、”低”或”相等”)原因是 。
化物的沸点 ,(填”高”、”低”或”相等”)原因是 。
(3)用电子式表示化合物eh的形成过程 。
(4)b和w可形成一种原子晶体,它的用途有 ,(答一种即 可)由化合物b(wa2)4在高温下分解可生成wa,和该原子晶体。则该原子晶体的化学式为 。
可)由化合物b(wa2)4在高温下分解可生成wa,和该原子晶体。则该原子晶体的化学式为 。
电解法促进橄榄石(主要成分是Mg2SiO4)固定CO2的部分工艺流程如下:
已知:Mg2SiO4(s) +4HCl(aq) 2MgCl2(aq) +SiO2 (s) + 2H2O(l)△H =-49.04 kJ·mol-1
2MgCl2(aq) +SiO2 (s) + 2H2O(l)△H =-49.04 kJ·mol-1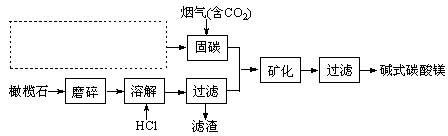
(1)某橄榄石的组成是Mg9FeSi5O20,用氧化物的形式可表示为。
(2)固碳时主要反应的方程式为NaOH(aq)+CO2 (g)=NaHCO3 (aq),该反应能自发进行的原因是。
(3)请在上图虚框内补充一步工业生产流程。
(4)下列物质中也可用作“固碳”的是。(填字母)
a.CaCl2 b.H2NCH2COONa c.(NH4)2CO3
(5)由图可知,90℃后曲线A溶解效率下降,分析其原因。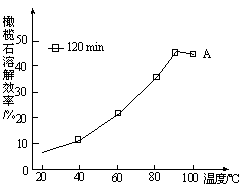
(6)经分析,所得碱式碳酸镁产品中含有少量NaCl和Fe2O3。为提纯,可采取的措施依次为:对溶解后所得溶液进行除铁处理、对产品进行洗涤处理。判断产品洗净的操作是。
化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO3-还原为N2。25℃时,反应进行l0 min,溶液的pH由7变为l 2。
①N2的结构式为
②上述反应的离子方程式为,其平均反应速率v(NO3-)为mol·L-1·min-1。
③还原过程中可生成中间产物NO2-,写出2种促进NO2-水解的方法。
(2)电化学降解NO3-的原理如下图所示。
①电源正极为(填“A”或“B”),阴极反应式为:
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为g。
已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ |
700 |
800 |
830 |
1000 |
1200 |
| 平衡常数 |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=,△H 0(填“>”“<”或“=”);
(2)830℃时,向一个5L密闭容器中充入0.20 mol A和0.80 mol B,如反应初始6s内A的平均反应速率v(A)=0.003mol·L-1·s-1,则6s时c(A)= mol·L-1,C的物质的量为mol;若反应经一段时间后,达到平衡时A的转化率为
,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ;
(3)判断该反应是否达到平衡的依据为(填正确选项前的字母);
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为
A(g)+B(g)的平衡常数的值为
(1)物质的量浓度相同的三种盐NX、NaY、NaZ的溶液,其pH依次为8、9、1 0,则HX、HY、HZ的酸性由强到弱的顺序是。
(2)比较下列溶液的pH(填“>”“<”或“=”):
①0.1 mol·L-1Na2CO3溶液0.1 mol·L-1NaHCO3溶液
②0.1 mol·L-1NH4Cl溶液0.01 mol·L-1NH4C1溶液
(3)把a、b、c、d四块金属片浸泡在稀H2SO4中,用导线两两相连,可以组成各种原电池。若a、b相连,a为负极;c、d相连,c为负极;a、c相连,c为正极;b、d相连,b为正极,则这四种金属的活动性由强到弱的顺序为 。
(4)将AlCl3溶液蒸干、灼烧,最后所得的固体的主要成份是。
(5)氯化铁溶液呈性(填“酸”、“碱”或“中”),原因是(用离子方程式表示):
(6)向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全时,溶液的pH7(填“>”“<”或“=”),离子反应总方程式为:。
把2.0 mol CuSO4和1.0 mol
CuSO4和1.0 mol H2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算:
H2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算:
(1)混合溶液中CuSO4和H2SO4的物质的量浓度
(2)混合液中和的物质的量浓度
(3)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余。此时溶液中的物质的量浓度。c(Fe2+)=_______________________。