下列液体均处于25℃,有关叙述正确的是
| A.某物质的溶液pH < 7,则该物质一定是酸或强酸弱碱盐 |
| B.pH=4的NH4Cl溶液,溶液中c(H+)>c(OH-),且c(H+)/c(OH-)=1×106 |
| C.AgCl在相同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同 |
| D.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小 |
关于下列各装置图的叙述中,正确的是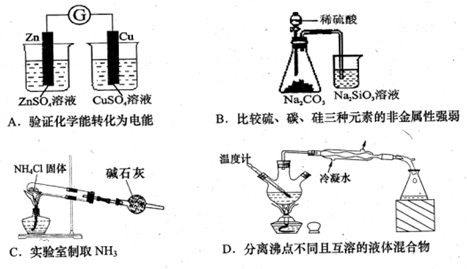
某溶液中除H+、OH-外,还含有大量的Mg2+、Fe3+、Cl-,且这三种离子的物质的量浓度之比为1: 1: 6.下列有关该溶液的判断正确的是
| A.向该溶液中加入KI溶液后,原有的五种离子物质的量不变 |
| B.向该溶液中摘加稀NaOH溶液,立即出现白色沉淀 |
| C.向该溶液中加入过量铁粉,只发生置换反应 |
| D.若溶液中c(Cl-)=0.6mol/L,则该溶液的pH为1 |
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁醋,反应温度为115-125℃,反应装置如图。下列对该实验的描述错误的是
| A.为使受热均匀,可改用水浴加热 |
| B.长玻璃管起冷凝回流作用 |
| C.提纯乙酸丁酯需要经过水、饱和碳酸钠溶液洗涤 |
| D.加入过量乙酸可以提高1-丁醇的转化率 |
某有机物与H2按1:1的物质的量之比加成后生成的产物结构为: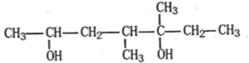
则该有机物可能的结构有(羟基与碳碳双键相连的结构不稳定,不考虑其存在)
| A.4种 | B.5种 | C.6种 | D.7种 |
美国科学家最近发明了利用眼泪来检侧糖尿病的装置,其原理是用氯金酸钠(NaAuCl4)溶液与眼泪中的葡萄糖反应生成纳米金单质颗粒(直径为20nm-60nm)。下列有关说法中错误的是
| A.葡萄糖具有还原性 |
B.葡萄糖的结构简式为 |
| C.检测时NaAuCl4发生氧化反应 |
| D.纳米金单质颗粒分散在水中所得的分散系能产生丁达尔效应 |