控制适合的条件,将反应Fe2++Ag+ Ag + Fe3+设计成如下图所示的原电池。下列判断错误的是
Ag + Fe3+设计成如下图所示的原电池。下列判断错误的是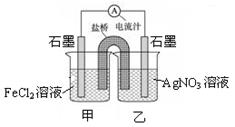
| A.反应开始时,电子从甲中石墨经导线流向乙中石墨 |
| B.电流计指针为零时,上述反应的正反应速率等于逆反应速率 |
| C.电流计读数为零后,在甲中加入FeCl3固体,乙中石墨电极反应为Ag - e- ="=" Ag+ |
| D.电流计读数为零后,在乙中加入硫化钠固体,电流计指针读数仍为零 |
下列各化学术语表达正确的是
A.Na原子结构示意图: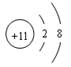 |
| B.乙烷的结构简式:CH3CH3 |
| C.HClO的结构式:H-Cl-O |
D.CH4分子的比例模型: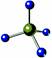 |
下列微粒和基团中,碳原子不满足最外层为8电子结构的是
| A.一氯甲烷(CH3Cl) |
| B.甲基(-CH3) |
| C.碳负离子(CH3—) |
| D.乙烯(C2H4) |
下列说法不正确的是
| A.氢气是一种环保、可再生的能源 |
| B.电解熔融AlCl3可制金属铝 |
| C.可溶性铁盐或铝盐常用于水的净化 |
| D.二氧化硅可用于制作光导纤维 |
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:
下列说法不正确的是
| A.溶解烧渣选用足量硫酸,试剂X选用铁粉 |
| B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为A1(OH)3,进入固体2 |
| C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解 |
| D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O |
下列有关物质应用的说法不正确的是
| A.铁制容器可盛装冷的浓硫酸,因为常温下铁和浓硫酸不反应 |
| B.Na2O2用作呼吸面具的供氧剂 |
| C.欲鉴别FeCl2溶液、AlCl3溶液和AgNO3溶液,向3种待测液中分别滴加足量氨水 |
| D.铝热反应需提供一定的能量引发,因为铝热反应为吸热反应 |