现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| A |
有三个电子层,K、M层电子数之和等于L层电子数 |
| B |
短周期中金属性最强 |
| C |
常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D |
元素最高正价是+7价 |
(1)用化学用语回答下列问题:
①A元素在周期表中的位置 ;
②B元素原子结构示意图 ;
③C单质分子的电子式 ;用电子式表示A和B元素组成的化合物的形成过程 ;
④D元素在自然界有两种核素,用原子符号表示其中子数为20的核素 。
(2)元 素D与元素A相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 (填选项序号)。
素D与元素A相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 (填选项序号)。
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A的最高价含氧酸酸性弱于D的最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(3)探寻物质的性质差异性是学习的重要方法之一。A、B、C、D四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种的是 (写化学式)。
(4)X是由A、B、C、D四种元素中的某种元素组成的单质,能经下图所示的过程转化为W(其他条件略去)。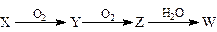
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,此白色沉淀的化学式为: ;生成该白色沉淀的化学方程式为 ;
② 若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂物质的量之比为: 。
若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂物质的量之比为: 。
在①CH2=CH2②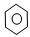 ③CH3CH2OH ④CH3COOH ⑤聚乙烯五种物质中:
③CH3CH2OH ④CH3COOH ⑤聚乙烯五种物质中:
(1)属于高分子化合物的是 ;(请填物质的序号,下同。);
(2)能使Br2的CCl4溶液褪色的是 ;
(3)既能发生取代反应又能发生加成反应的是 ;
(4)能与Na2CO3溶液反应的是 ;
(5)能发生酯化反应的是 ;
现有A、B、C三种烃,其球棍模型如下图: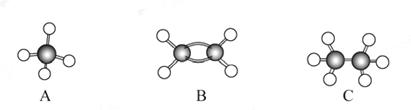
(1)等质量的以上物质完全燃烧时耗去O2的量最多的是_____(填对应字母,下同);
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是_____;
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是_____,生成水最多的是_____。
(4)在120 ℃、1.01×105Pa下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是_____。
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应。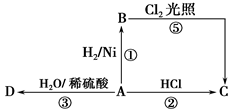
据图回答下列问题:
(1)写出A、C、D的结构简式:A________, C________, D________。
(2)写出①②两步反应的化学方程式,并注明反应类型:
①________________________________________________反应类型为____________。
②_______________________________________________
下列物质中互为同分异构体的有 ,互为同素异形体的有 ,属于同位素的有 ,属于同一种物质的有 。(填序号)
①液氯 ②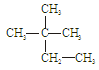 ③白磷 ④18O ⑤
③白磷 ④18O ⑤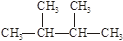
⑥红磷⑦16O⑧氯气
有机高分子化合物在日常生活中有非常广泛的应用。一种广泛应用于电器、工业交通的工程塑料DAP的结构简式是: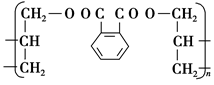
试回答:
(1)生产DAP工程塑料的单体的结构简式是__________________________。
(2)DAP工程塑料的单体,可以由两种有机物通过一步反应合成出来,则这两种有机物的结构简式是____________________和_______________。