N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程中正确的是
| A.1/2 N2H4(g)+ 1/2 O2(g)= 1/2 N2(g)+ H2O(l)△H = +257kJ·mol-1 |
B.N2H4(g)+O2(g)=N2(g)+2H2O(l)△H = -133.5kJ·mol-1 |
C.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H = +534kJ·mol-1 |
D.N2H4(g )+O2(g)=N2(g)+2H2O(g)△H = -534kJ·mol-1 )+O2(g)=N2(g)+2H2O(g)△H = -534kJ·mol-1 |
以下能级符号错误的是
| A.5s | B.3d | C.3f | D.6p |
下列电子式错误的是
A. |
B. |
C. |
D.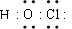 |
ClO2是一种消毒效率高,二次污染小的水处理剂。实验室可以通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是
| A.KClO3在反应中失去电子 | B.ClO2是氧化产物 |
| C.H2C2O4在反应中被氧化 | D.1mol KClO3参加反应有2mol电子转移 |
下列判断错误的是
| A.沸点:NH3>PH3>AsH3 | B.熔点:Si3N4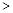 NaCl NaCl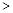 SiI4 SiI4 |
| C.酸性:HClO4>H2SO4>H3PO4 | D.碱性:NaOH>Mg(OH)2>Al(OH)3 |
下列叙述正确的是
| A.离子晶体中,只存在离子键,不可能存在其它化学键 |
| B.在卤族元素(F、Cl、Br、I)的氢化物中,HF的沸点最低 |
| C.NaHSO4、Na2O2晶体中的阴、阳离子个数比均为1 : 2 |
| D.晶体熔点:金刚石>食盐>冰>干冰 |