有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl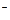 离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为( )
离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为( )
| A.(y-2x)/a | B.(y-x)/a | C.(2y-2x)/a | D.(2y-4x)/a |
已知A、B、C、D、E五种主族元素分别位于第1、2、3周期,原子序数依次增大,其中A与C、B与D分别同主族,且B原子的最外层电子数等于A与C原子序数之和的一半,下列叙述正确的是
A.原子半径:A<B<C<D<E
B.D、E的气态氢化物的热稳定性:D>E
C.A与B、C与B均能形成X2Y2型化合物,且其中所含有的化学键类型相同
D.另外四种元素能够分别与C形成含单原子核阴离子的离子化合物
下列装置能达到实验目的的是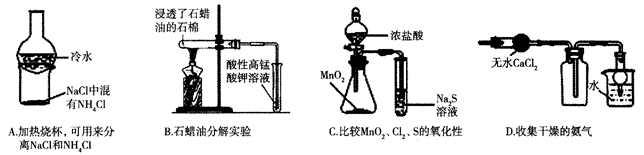
已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=8.0×10-38,Kb(NH3·H2O)=1.8×10-5,下列叙述中不正确的是
| A.25℃时,向等浓度的MgCl2和FeCl3混合溶液中逐滴加入氨水,先出现红褐色沉淀 |
| B.25℃时,MgCl2溶液中有少量FeCl3时,可以加入MgO进行除杂 |
| C.25℃时,加大量水稀释氨水,电离程度增大,溶液导电能力增强 |
D.25℃时,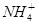 +H2O +H2O NH3·H2O+H+的平衡常数为5.6×10-10 NH3·H2O+H+的平衡常数为5.6×10-10 |
某化学兴趣小组为了探究铬和铁的活泼性,设计如图所示装置,下列推断合理的是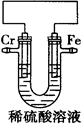
| A.若铬比铁活泼,则电子经外电路由铁电极流向铬电极 |
| B.若铬比铁活泼,则铁电极反应式为2H++2e-=H2↑ |
| C.若铁比铬活泼,则溶液中H+向铁电极迁移 |
| D.若铁电极附近溶液pH增大,则铁比铬活泼 |
某有机物的结构简式如图所示,下列有关该有机物的说法中正确的是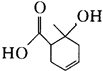
| A.能和碳酸钠溶液反应的官能团有2种 |
| B.1mol该有机物最多能与2molH2发生加成 |
C.与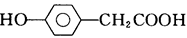 互为同分异构体 互为同分异构体 |
| D.既可以发生取代反应又可以发生氧化反应 |