下列物质中最简式相同,但既不是同系物,也不是同分异构体,又不含相同官能团的是
A.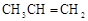 和 和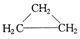 |
B.乙炔和苯 |
C.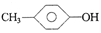 和 和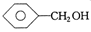 |
D.甲醛和甲酸甲酯 |
用乙炔为原料制取CH2Br—CHBrCl,可行的反应途径是
| A.先加Cl2,再加Br2 | B.先加Cl2,再加HBr |
| C.先加HCl,再加HBr | D.先加HCl,再加Br2 |
以下实验中能够获得成功的是
| A.将乙烷和氯气的混合气放在光照条件下反应制备氯乙烷(C2H5Cl) |
| B.将乙醇迅速加热至170℃制乙烯 |
| C.将还原铁粉、液溴和苯混合制溴苯 |
| D.检验氯代烃中含氯,加NaOH溶液加热后,用稀硫酸酸化,再检验 |
某有机物的结构简式为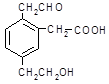 ,它在一定条件下可能发生的反应是
,它在一定条件下可能发生的反应是
①加成;②水解;③酯化;④氧化;⑤中和;⑥消去;⑦还原
| A.①③④⑤⑥⑦ | B.①③④⑤⑦ | C.①③⑤⑥⑦ | D.②③④⑤⑥ |
下图是一种有机物的比例模型,该模型代表的有机物可能是
| A.饱和一元醇 | B.羟基酸 | C.羧酸酯 | D.饱和一元醛 |