(8分)由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),右下图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),右下图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。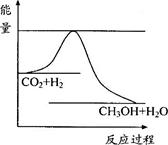
(1)关于该反应的下列说法中,正确的是_______。
A.△H>0,△S>0; B.△H>0,△S<0;
C.△H<0,△S<0; D.△H<0,△S>0。
(2)该反应平衡常数K的表达式为_______________。
(3)温度降低,平衡常数K_____(填“增大”、“不变”或“减小”)。
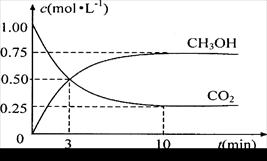
(4)为探究反应原理,现进行如下实验:在体积为2L的密闭容器中,充入2mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如右图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2) 为:
________________________
(5)下列措施中能使n(CH3OH)/n(CO2)增大的有______。
A.升高温度; B.加入催化剂;
C.将H2O(g)从体系中分离; D.再充入1molCO2和3molH2;
E.充入He(g),使体系总压强增大。
①②③④⑤五种元素,在元素周期表中的位置如图所示。回答下列问题: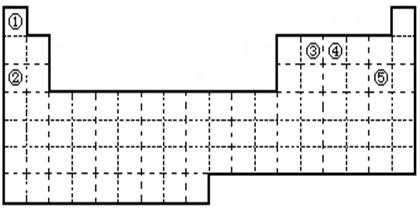
(1)①②③④⑤五种元素中,金属性最强的元素是 (写元素名称), 该元素的单质在空气中燃烧的化学方程式为 。
(2)元素②的最高价氧化物对应的水化物属于 化合物,(填“共价”或“离子” ),其电子式为 , 试比较②和③原子半径的大小
② ③(填“﹥” 或“﹤” )
(3)画出元素④的原子结构示意图 ,该元素的最高价氧化物的
水化物能与Cu发生反应,反应中作氧化剂的是(写化学式) 。
(4)写出元素⑤在周期表中的位置 ,以海水中含量最大的物质为原料可以生产⑤的单质,同时还可以得到另外两种重要的工业原料,该反应的化学方程式为 。
(5)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外L层电子数是M层电子数的4倍。
①甲、乙元素分别为 、 (写元素名称)
②写出②的最高价氧化物对应的水化物与甲的最高价氧化物反应的离子方程式
工业上将磷酸钙、石英砂和炭粉混在电弧炉中焙烧来制取白磷:
Ca3(PO4)2+SiO2+C—CaSiO3+P4+CO↑
(1)配平以上方程式
Ca3(PO4)2+ SiO2+C=CaSiO3+P4+ CO↑
(2)已知白磷熔点为44.1℃,熔点280℃,据此判断其晶体类型属于
(3)有一种磷的结构式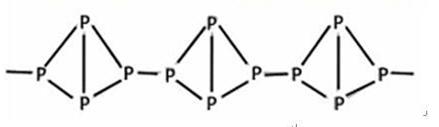 ,
,
有关它的叙述肯定不正确的是
| A.它在空气中完全燃烧的产物是P2O5 | B.它不溶于水 |
| C.它在常温下呈固态 | D.它与白磷互为同分异构体 |
NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究热点,NO亦被称为“明星分子”。请回答下列问题:
(1)NO对环境的危害在于(填编号)
A.破坏臭氧层 B.光化学烟雾 C.造成酸雨
(2)下列关于NO的说法不正确的是
A.NO为无色气体
B.NO在空气中很不稳定
C.NO是汽车尾气的有害成分之一
D.NO分子所含电子总数为偶数
(3)在含Cu+离子的酶的活化中,亚硝酸根 (NO2—)离子可转化为NO ,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式
“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),若以它为原料,按如下工艺流程图,即可制得“轻质氧化镁”。如果要求产品尽量不含杂质离子,而且成本较低,流程中所用试剂或pH值控制可参考下列附表确定。轻质氧化镁工艺流程图如下:
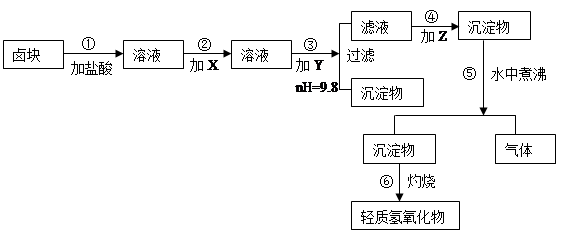
表1 化学试剂价格表
| 试剂 |
价格(元/ t ) |
| 漂液(含NaClO25.2%) H2O2(30%) NaOH(固98%) Na2CO3(固99.5%) 卤块(MgCl2,30%) |
450 2400 2100 600 310 |
表2 生成氢氧化物沉淀的值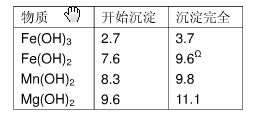
| 物质 |
开始沉淀 |
沉淀完全 |
| Fe(OH)3 Fe(OH)2 Mn(OH)2 Mg(OH)2 |
2.7 7.6 8.3 9. 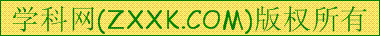 6 6 |
3.7 9.6Ω 9.8 11.1 |
Ω注:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化成为Fe3+,生成Fe(OH)3沉淀而去除之。请填写以下空白:
⑴、在步骤②加入试剂X,最佳选择应是 ,其作用是 。
⑵、在步骤③加入的试剂Y应是 ,之所以要控制pH=9.8,其目的
是 。
⑶、在步骤⑤时发生的化学反应方程式是: 。
有A、B、C、D、E五种短周期元素,其原子序数依次增大。A原子的电子层数与它的核外电子总数相同,B原子核外最外层电子数是次外层电子数的2倍,C元素的原子基态时2p能级是2s能级上的电子数的2倍,D是该周期中原子半径最大的主族元素,E原子的第一至第四电离能(kJ·mol-1)分别为:578、1817、2745、11575。请回答下列问题: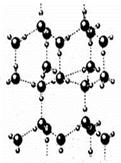
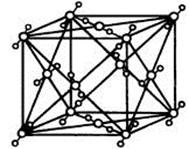
(1)C、D两元素形成的化合物的晶体类型是 。BC2的结构式 ;在一定温度下,用x射线衍射法测BC2晶胞(晶体中最小的重复单位)边长: a=5.72×10-8cm,该温度下BC2的密度为
(2)若F是D的同主族下一周期元素,则F的电子排布式是: ,
(3)写出E的最高价氧化物对应的水化物与D的最高价氧化物对应的水化物反应的离子方程式 。
(4)A2C分子间因存在“氢键”的作用而彼此结合形成(A2C)n。在该分子形成的晶体中每个A2C分子被4个A2C分子包围形成变形的四面体,通过“氢键”相互连接成庞大的分子晶体,其结构示意图如右图所示,试填空。
①含1molA2C的该晶体中有_____mol“氢键”。
②若G是C的同主族下一周期元素,请比较A2C与A2G沸点的高低______________。(填分子式)