在一瓶无色未知溶液中检验出有Ba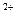 、Ag
、Ag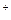 ,同时又测得其酸性很强。某学生还要鉴定此溶液中是否大量存在:①Cu
,同时又测得其酸性很强。某学生还要鉴定此溶液中是否大量存在:①Cu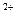 、②Fe
、②Fe 、③ Cl
、③ Cl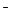 、④ NO
、④ NO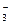 、⑤ S
、⑤ S 、⑥ CO
、⑥ CO 、⑦ NH
、⑦ NH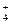 、⑧ Mg
、⑧ Mg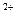 、⑨A1
、⑨A1 、⑩
、⑩ 离子。其实,这些离子中有一部分不再鉴定就能加以否定,你认为不必鉴定的离子组是( )
离子。其实,这些离子中有一部分不再鉴定就能加以否定,你认为不必鉴定的离子组是( )
| A.③⑤⑥⑦⑩ | B.①②⑤⑥⑧⑨ | C.③④⑦⑧⑨ | D.①②③⑤⑥⑩ |

 某同学用沉淀法测定碳酸钠和氢氧化钠混合物中氢氧化钠的质量分数,有关叙述如下:
某同学用沉淀法测定碳酸钠和氢氧化钠混合物中氢氧化钠的质量分数,有关叙述如下:
①检验 是否完全沉淀的操作方法是,取上层清液装于试管,向试管滴加沉淀剂溶液
是否完全沉淀的操作方法是,取上层清液装于试管,向试管滴加沉淀剂溶液
②检验 是否完全沉淀的操作方法是向上层清液中继续滴加沉淀剂溶液
是否完全沉淀的操作方法是向上层清液中继续滴加沉淀剂溶液
③用氯化钡溶液代替氯化钙溶液作沉淀剂,优点是实验结果准确度较高
④用氯化钡溶液代替氯化钙溶液作沉淀剂,优点是碳酸钡能完全沉淀
其中正确的是()
| A.①③ | B.②③ | C.②④ | D.①④ |
 能正确表示下列反应离子方程式是
能正确表示下列反应离子方程式是
A.向次氯酸钙溶液通入过量C O2:Ca2++2ClO-+CO2+H2O =CaCO3↓+2HClO O2:Ca2++2ClO-+CO2+H2O =CaCO3↓+2HClO  |
B.向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O= CaSO3↓+2HClO  |
C.氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O  |
D.在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O  |
下列实验合理的是( )
 |
 |
 |
 |
| A、配制一定浓度硫酸 |
B、制备少量氨气 |
C、制备并收集少量NO2气体 |
D、制备少量氧气 |
有Fe2+、NO3-、Fe3+、NH4+、H+ 和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是
| A.氧化剂与还原剂的物质的量之比为8:l |
| B.还原产物为NH4+ |
| C.若有l mol NO3-参加还原反应,则转移8mol e- |
| D.若把该反应设计为原电池,则负极反应为Fe 2+ -e-=Fe 3+ |
把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含 b mol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
A. |
B. |
C. |
D. |