在通常条件下,下列各组物质的性质排列不正确的是( )
| A.熔点:CO2<KCl<SiO2 | B.沸点:乙烷>戊烷>2-甲基丁烷 |
| C.密度:苯<水<1,1,2,2-四溴乙烷 | D.热稳定性:HF>HCl>H2S |
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法不正确的是()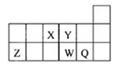
| A.离子半径的大小顺序为:r(W2-)>r(Q-)>r(Y2-)>r(Z3+) |
| B.若存在简单阴离子R2-,则R不一定与Y、W同主族 |
| C.元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键 |
| D.X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应 |
能正确表示下列反应的离子方程式是()
A.用石墨作电极电解氯化镁溶液:2H2O+2Cl-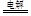 H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
B.用过量氨水吸收工业尾气中的SO2:2NH3·H20+SO2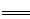 2NH4++SO32-+H2O 2NH4++SO32-+H2O |
C.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-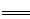 3Fe3++NO↑+3H2O 3Fe3++NO↑+3H2O |
| D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀: |
2Ba2++3OH-+Al3++2SO42-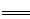 2BaSO4↓+Al(OH)3↓
2BaSO4↓+Al(OH)3↓
设NA为阿伏加德罗常数的值,下列叙述正确的是 ()
| A.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
| B.标准状况下,1.12L 16O2和1.12L18O2均含有0.1NA个氧原子 |
| C.0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.3NA |
| D.常温下,1L 0.1 mol·L-1的Na2CO3溶液中含有的离子总数为0.3NA |
下列实验装置不能达到实验目的的是()
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O。用湿润的淀粉碘化钾试纸检验气体时,试纸先变蓝后褪色。下列有关说法正确的是()
| A.由反应可确定:氧化性HClO4>HClO3 |
| B.该反应的还原产物是O2和HClO4 |
| C.试纸先变蓝后褪色是因为Cl2具漂白性 |
| D.若化学计量数a=8,b=3,则该反应转移电子数为20e- |