下表是元素周期表的前三周期:
| |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 一 |
A |
|
|
|
|
|
|
|
| 二 |
B |
|
|
C |
D |
E |
F |
|
| 三 |
G |
|
H |
|
|
|
I |
J |
回答下列问题:
(1)写出下列元素的元素的符号:F______________、J_____________。
(2)G元素与E元素形成的化合物的化学式是____________、____________,它们都是_________________(填“离子”或“共价”)化合物。
(3)表格中十种元素的最高氧化物对应的水化物中,酸性最强的是_____________,属于两性氢氧化物的是_______________(用化合物的化学式表示)。
(4)只含有A、C两种元素的化合物称为_____________,这些化合物中:
①相对分子质量最小的是________________,该化合物的分子空间构型是_______________;
②分子中含有双键,但原子数最少的是______________,它与HCl反应的化学方程式为______________________________;
(5)将H单质与C的一种单质(导体)按如下图装置连接,该装置称为_____________。其中C极为______________,(填正负极)并写出该电极反应式为:____________________。请在下图中标出电子流动方向。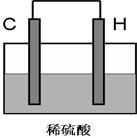
如图所示为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单位。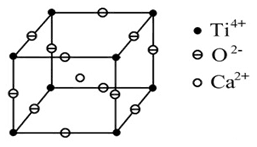
(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的氧离子、钙离子各有 、 个。
(2)该晶体结构中,元素氧、钛、钙的离子个数比是 ,该物质的化学式可为 。
(3)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为d nm(1 nm=10-9 m),阿伏加德罗常数为6.02×1023 mol-1,则该晶体的密度为 g·cm-3。
石墨的片层结构如图所示,试完成下列各题:
(1)平均 个碳原子构成一个正六边形。
(2)石墨晶体每一层内碳原子数与C—C化学键之比是 。
某有机物的结构式如下: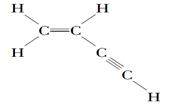
则分子中有________个σ键,________个π键。
(1)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是________(填“极性”或“非极性”)分子。
(2)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有________(填序号),CS2分子的空间构型是________。CO2与CS2相比,________的熔点较高。
已知N、P同属于元素周期表的第VA族元素,N在第2周期,P在第3周期。NH3
分子呈三角锥形,氮原子位于锥顶,三个氢原子位于锥底,N—H键间的夹角是107°。
(1)PH3分子与NH3分子的构型关系是________(填“相同”或“相似”或“不相似”),P—H______极
性(填“有”或“无”),PH3分子________极性(填“有”或“无”)。
(2)NH3与PH3相比,热稳定性________(填化学式)更强。
(3)NH3、PH3在常温、常压下都是气体,但NH3比PH3易液化,其主要原因是________.
| A.键的极性N—H比P—H强 | B.分子的极性NH3比PH3强 |
| C.相对分子质量PH3比NH3大 | D.NH3分子之间存在特殊的分子间作用力 |