已知:
(1)傅瑞德尔一克拉福茨反应是在苯环上引入烷基的反应: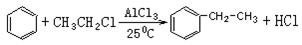
(2)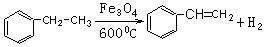
(3)烯烃与HX(X为原子或原子团)加成时,氢原子总是加在含氢较多的不饱和碳上,
即: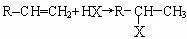
某同学给出了以乙烯、苯、食盐、水等为原料合成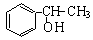 的部分流程图:
的部分流程图:
试回答下列问题:
(1)反应物A可由食盐、水经一系列反应获得,则反应物A为 (填化学式),写出制备A 的化学方程式
(2)反应物B为 (填化学式)
(3)反应Ⅰ~ Ⅳ中,属于加成反应的是 (填序号)
(4)中间产物C的属于芳香烃的同分异构体有 种(不包括自身),其中苯环上的一氯代物有2种的是 (写结构简式)
(5)下列关于中间产物D的说法不正确的是
| A.既能使酸性高锰酸钾溶液褪色,也能使溴水褪色 |
| B.既能溶于水,也能溶于苯中 |
| C.1mol 中间产物D最多可与4mol H2完全反应 |
| D.所有原子不可能共平面 |
有A、B、C、D、E五种短周期元素,原子半径依次减小。E元素与其它元素不在同一周期。C、D在周期表中处于相邻位置,它们的单质在通常状况下均为无色气体。A、B同周期,A2B是离子化合物。请回答:
(1)A2B的名称为。
(2)写出D与E形成的具有10电子的4核阳离子的离子符号;C与E形成的4核分子的结构式为。
(3)由上述五种元素中的某几种元素所形成的具有漂白作用的物质的化学式是:_______________(任意写一种)。
(4)B的最高价氧化物的水化物的浓溶液有强氧化性,加热时金属铜可被它氧化,该反应的化学方程式为。
(5)由以上五种元素两两组合所形成的化合物中,有些物质能与水反应生成气体且属于氧化还原反应,请写出其中一个反应的化学方程式。
A-E六种元素中,除A外均为短周期元素,它们的原子结构或性质如表所示:
| 序号 |
元素 |
结构或性质 |
| ① |
A |
生活中常见的金属,它有两种氯化物,相对分子质量相差35.5 |
| ② |
B |
原子最外层电子数是内层电子数的1/5 |
| ③ |
C |
K层和M层上电子数之和等于L层上电子数 |
| ④ |
D |
与B同周期,且最外层电子数等于电子层数 |
| ⑤ |
E |
1—20号元素中原子半径最大(除稀有气体外) |
(1)工业上利用D单质与A的一种红色氧化物反应,在野外焊接钢轨,其化学方程式:。
(2)分别由A、B、D、E所形成的简单离子中,具有还原性的离子是,氧化性最弱的离子是。(填离子符号)
(3)D的最高价氧化物对应水化物常用于治疗胃酸(含盐酸)过多症,请写出有关反应的化学方程式。
(4)证明物质中含有E元素的方法是:用洁净的铂丝棒蘸取少量含E元素的物质在酒精灯上灼烧,能够观察到色火焰。
(5)B与D形成的合金是工业上重要的材料。写出该合金在工业上的一个用途。某同学仅使用天平和右图所示的装置测定某些数据即可求出该合金中B元素的含量。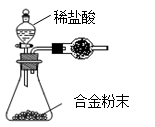
①实验需要测定三个物理量:合金的质量m、a和b。
a是反应前装置和药品的总质量;
b是;
②干燥管中盛放的试剂最好是。
③合金中B元素的质量分数是(用m、a、b表示)。
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
||
| 2 |
① |
⑧ |
② |
|||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
(1)②、④、⑤的原子半径由大到小的顺序为____________________。
②、④、⑤的离子半径由大到小的顺序为____________________。
(2)①②⑥⑦四种元素所对应的气态氢化物最稳定的是________,最不稳定的是_____(填化学式)。
(3)②、③可形成既含离子键又含共价键的化合物,其阳离子和阴离子的个数比为_____。
(4)③、⑤两元素最高价氧化物对应水化物发生反应的离子方程式为__________________________。
(5)工业上用①单质大量生产⑥单质,反应的化学方程式为_______________________________。
(6)④⑤两元素相比较,金属性较强的是(填名称),用原子结构知识解释,可以验证该结论的实验是(填编号)。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同的这两种元素的单质分别和热水作用,并滴入酚酞溶液
(d)分别往氯化镁溶液、氯化铝溶液中逐滴滴入氢氧化钠溶液直到过量。
(7)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应: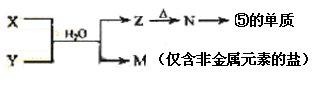
X溶液与Y溶液反应的离子方程式为_____________________,
按要求填空:
(1)某阴离子核外18电子,带两个单位负电荷,其离子结构示意图。
(2)含6个质子、8个中子的原子符号为,它与16O形成3原子分子甲,4.6克甲的物质的量是mol,甲分子中相邻原子间以键结合(填“离子键”或“共价键”)。
(3)铁原子核外有4个电子层,在周期表第8列,它在元素周期表的第周期族。
(4)盛放碱液的试剂瓶不能用玻璃塞,是为了防止发生
反应(以NaOH为例用化学方程式表示),避免瓶塞与瓶口粘在一起
A、B两种酸式含氧酸盐的相对分子量均为120,且都溶于水;D气体能使品红溶液褪色;F固体为淡黄色;E是不溶于水和盐酸的白色沉淀,它们之间的转化关系如图所示: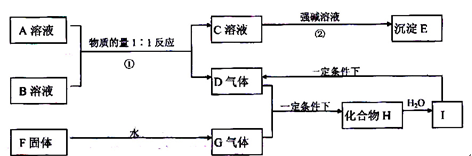
(1)写出化学式:F____________;G___________;D___________;H___________。
(2)写出反应②的离子方程式:
②:_______________________________________________________。
(3)写出一个由I生成D的化学方程式:_______________________________。