甲苯(C7H8)和甘油(C3H8O3)组成的混合物中,若碳元素的质量分数为60%,那么可以推断氢元素的质量分数约为 ( )
| A.5% | B.8.7% |
| C.17.4% | D.无法计算 |
证明溴乙烷中溴的存在,下列正确的操作步骤为
①加入AgNO3溶液 ②加入NaOH水溶液 ③加热 ④加入蒸馏水 ⑤加稀硝酸至溶液呈酸性 ⑥加入NaOH醇溶液
| A.④③①⑤ | B.②③⑤① | C.④⑥③① | D.③⑥⑤① |
下列纯净物不能和金属钠反应的是
| A.苯酚 | B.甘油 | C.酒精 | D.苯 |
分离苯和苯酚的混合物,通常采用的方法是
| A.加水振荡后用分液漏斗分离 | B.加稀盐酸振荡后用分液漏斗分离 |
| C.加氢氧化钠溶后用分液漏斗分离 | D.加溴水振荡后滤去白色沉淀 |
某烃的结构简式为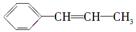 ,它可能具有的性质是
,它可能具有的性质是
| A.易溶于水,也易溶于有机溶剂 |
| B.既能使溴水褪色,又能使酸性KMnO4溶液褪色 |
C.能发生聚合反应,其产物可表示为 - - |
| D.能使溴水褪色,但不能使酸性KMnO4溶液褪色 |
下列关于卤代烃的说法正确的是
| A.在溴乙烷(CH3CH2Br)分子中,溴元素的存在形式为溴离子 |
| B.在卤代烃中,卤素原子与碳原子形成共价键 |
| C.聚四氟乙烯(塑料王)为高分子化合物,不属于卤代烃 |
| D.卤代烃比相应的烷烃的沸点低 |