下列各组物质熔点由低到高排列的是:
| A.H2O 、H2S 、H2Se 、H2Te | B.F2 、Cl2 、Br2、I2 |
| C.Li 、 Na 、 K、 Rb | D.NaCl 、MgCl2、金刚石、晶体硅 |
下列图像能正确反映所对应实验的是
| A.①为向pH=13的NaOH溶液中不断加水 |
| B.②为向MnO2中加入一定量的H2O2溶液 |
| C.③为向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 |
| D.④为将氨气通入醋酸溶液中 |
一定条件下,在容积为10L的密闭容器中,将l mol X和1 mol Y进行如下反应:2X(g)+Y(g)  Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是
Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是
| A.60 s时Z的平衡浓度为0.03 mol/L |
| B.将容器容积变为20 L,Z的新平衡浓度将等于原平衡浓度的一半 |
| C.若温度和体积不变,往容器内增加1 mol Y,Y的转化率将增大 |
| D.若升高温度,X的体积分数增大,则正反应的△H>0 |
某温度下,相同体积、相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如下图所示。据图判断正确的是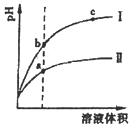
| A.Ⅱ为盐酸稀释时的pH值变化曲线 |
| B.b点溶液的导电性比c点溶液的导电性强 |
| C.a点KW的数值比c点KW的数值大 |
| D.b点酸的总浓度大于a点酸的总浓度 |
在室温下,0.1mol/L 100ml的醋酸溶液中,欲使其溶液的pH减小,但又要使醋酸电离程度减少,应采取
| A.加入少量CH3COONa固体 | B.通入少量HCl气体 |
| C.升高温度 | D.加入水 |
在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0,下列对图像的分析中不正确的是
CO2(g)+H2(g) ΔH<0,下列对图像的分析中不正确的是
| A.图Ⅰ研究的是t0时升高温度对反应速率的影响 |
| B.图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 |
| C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂 |
| D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 |