下列离子方程式正确的是
| A.碳酸氢镁溶液和过量的NaOH溶液反应:Mg2++2OH-=Mg(OH)2↓ |
| B.二氧化硫气体通入过量的Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
| C.Ba(OH)2溶液中滴入NaHSO4至pH等于7:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
D.KHS的水解HS-+H2O 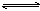 H2S+OH- H2S+OH- |
下列有关金属的说法中不正确的是
| A.纯铁比生铁的抗腐蚀性强 |
| B.青铜、不锈钢、硬铝都是合金 |
| C.铝在空气中耐腐蚀,所以铝是不活泼金属 |
| D.人体缺钙会引起骨质疏松症,缺铁会引起贫血 |
在密闭容器中,加热等物质的量的NaHCO3和Na2O2的固体混合物,充分反应后,容器中的固体剩余物是
| A.Na2CO3和Na2O2 | B.Na2CO3和NaOH |
| C.NaOH和Na2O2 | D.NaOH、Na2O2和Na2CO3 |
下列所得溶液的物质的量浓度等于0.1 mol·L-1的是
| A.将0.1 mol氨充分溶解在1 L水中 |
| B.将10 g质量分数为98%的硫酸与990 g水混合 |
| C.将8 g三氧化硫溶于水并配成1 L溶液 |
| D.将0.1 mol氧化钠溶于水并配成1 L溶液 |
由硫酸钾、硫酸铝和硫酸组成的混合溶液,其c(H+)=0.1 mol·L-1,c(Al3+)=0.4 mol·L-1,c(SO42-)=0.8 mol·L-1,则c(K+)为
| A.0.15 mol·L-1 | B.0.2 mol·L-1 |
| C.0.3 mol·L-1 | D.0.4 mol·L-1 |
NA代表阿伏加德罗常数,下列说法正确的是
| A.同温同压下,相同体积的任何气体单质所含的原子数相同 |
| B.1 mol过氧化钠中阴离子所带的负电荷数为2NA |
| C.常温常压下,11.2 L氮气所含的原子数目为NA |
| D.某温度时,pH=6的纯水中,含10-6NA个OH- |