过量铁粉与稀硝酸反应的方程式为:
Fe+HNO3(稀)→Fe(NO3)2+NO↑+H2O
(1)请写出上述反应配平的离子方程式 ;
(2)标准状况下,当生成2.24L NO气体时,转移电子的物质的量为 ,有 mol氧化剂被还原。
[化学一选修3:物质结构与性质]第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。其中Ni-Cr-Fe合金是常用的电热元件材料。请回答:
(1)基态Ni原子核外电子排布式为_______;第二周期中基态原子未成对电子数与Ni相同且电负性大的元素为________。金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO) ,该分子呈正四面体构型。试推测Ni(CO)
,该分子呈正四面体构型。试推测Ni(CO) 的晶体类型为________,Ni(CO)
的晶体类型为________,Ni(CO) 易溶于下列_______(填选项字母)中。
易溶于下列_______(填选项字母)中。
| A.水 | B.四氯化碳 | C.苯 | D.硫酸镍溶液 |
(2)FeO、NiO晶体中r(Ni2+)和r(Fe2+)分别为69 pm和78 pm,则熔点NiO_________FeO(填“>”或“<”),原因为_____________;黄血盐是一种配合物,其化学式为K4[Fe(CN)6] ·3H2O,该配合物中配体的化学式为_________,黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与该配体互为等电子体的气态化合物,该反应的化学方程式为_______________。
(3)酸性高锰酸钾溶液能氧化硝基苯酚,邻硝基苯酚和对硝基苯酚在20 水中的溶解度之比为0.39,其原因为_________。
水中的溶解度之比为0.39,其原因为_________。
(4)在铬的硅酸盐中,SiO44-四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中Si原子的杂化形式为________,其化学式为_________。
[化学一选修2:化学与技术]海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河人海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、蒸发池和________池。
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜 只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用_______(写一点即可)。
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。
①海水不能直接通入到阴极室中,理由是______________.
②A口排出的是_______(填“淡水”或“浓水”)。
(3)用苦卤(含 Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下:
①若吸收塔中的溶液含BrO3-,则吸收塔中反应的离子方程式为___________。
②通过苦卤中通入Cl2已获得含溴的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液________。
③向蒸馏塔中通入水蒸气加热,控制温度在90 左右进行蒸馏的原因是___________。
左右进行蒸馏的原因是___________。
汽车尾气中含有NO、CO和碳颗粒等有害物质,已成为某些大城市空气的主要污染源。
(1)汽车燃料中一般不含氮元素,汽缸中生成NO的原因为(用化学方程式表示为可逆反应)________;汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,试分析其原因________。
(2)治理汽车尾气中NO和CO污染的一种方法是将其转化为无害的和,反应原理为: 2CO(g)+2NO (g)  CO2(g)+N2 (g) △H<0,某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.4 mol NO和0.4 molCO,在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示:
CO2(g)+N2 (g) △H<0,某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.4 mol NO和0.4 molCO,在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示:
①计算实验Ⅱ从开始至达到平衡时的反应速率v(N0)=________。
②图中三组实验从开始至达到平衡时的反应速率v( NO)由大到小的顺序为__________(填实验序号)。
③与实验Ⅱ相比,实验I和实验Ⅲ分别仅改变一种反应条件,所改变的条件和判断的理由为:
实验I__________________________________________;
实验Ⅲ________________________________________。
④三组实验中CO的平衡转化率α1(CO)、αII(CO)和αIII(CO)的大小关系为____________。
⑤计算实验Ⅲ的平衡常数K=____________。
(1) 氨催化氧化法是工业制硝酸的主要方法,可进行连续生产。
已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式_____________________________。
(2) 恒容密闭容器中进行的合成氨反应,其化学平衡常数K与温度t的关系如下表:
| t/K |
298 |
398 |
498 |
… |
| K |
4.1×106 |
K1 |
K2 |
… |
①写出合成氨反应N2(g)+3H2(g) 2NH3(g)的平衡常数表达式:__________________________
2NH3(g)的平衡常数表达式:__________________________
②上表中K1_______K2(填“>”、“=”或“<”)。
(3) 如果向氨合成塔中充入10molN2和40molH2进行氨的合成,图A和图B为一定温度下平衡混合物中氨气的体积分数与压强(p)的关系图。
①下列说法正确的是__________(填序号)。
A.图中曲线表明增大体系压强(p),有利于提高氨气在混合气体中体积分数
B.如果图B中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度可有效提高反应速率和氮气的转化率
D.当 2v正(H2) =3v逆(NH3)时,反应达到平衡状态
E.容器内混合气体密度保持不变时,反应达到平衡状态
②图A中氨气的体积分数为15%时,N2的转化率为。
(4)在1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨,其实验装置如图C,则正极的电极反应式。
(5)25 ℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是()。
A.25 ℃时,饱和Mg(OH)2溶液中c(OH—)大于饱和MgF2溶液中c(F—)
B.25 ℃时,某饱和Mg(OH)2溶液中c(Mg2+)=0.056 1 mol·L-1,则溶液的pH=9
C.25 ℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,溶液变澄清,Ksp[Mg(OH)2]增大
D.25 ℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2可能转化为MgF2
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)CO2的电子式为:。
(2)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(系数按顺序填在答题卷上)
___ C+ ___ KMnO4+ ____ H2SO4 = ____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(3)甲醇是一种新型燃料,工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+ 2H2(g) CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
已知: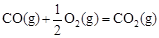 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1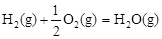 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为;
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的燃料电池装置。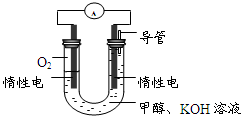
①该电池负极的电极反应为:。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为。
(5)在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。利用图中a点对应的数据,计算出曲线Z在对应温度下 CO(g)+ 2H2(g) CH3OH(g)的平衡常数K =。
CH3OH(g)的平衡常数K =。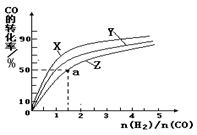
(6)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10-5 mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为。