某原电池的总反应的离子方程式是:Zn+Cu2+==Zn2++Cu,此反应的原电池的正确组成是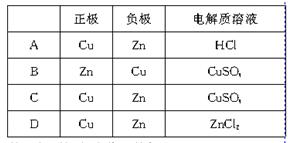
NA为阿伏加德罗常数的值。下列叙述正确的是
| A.标准状况下,11.2 L H2O中氧原子的数目大于0.5 NA |
| B.6.0 g醋酸晶体中含有H+的数目为0.1 NA |
| C.64gCu粉与足量硫粉加热完全反应生成Cu2S时失去的电子数为2NA |
| D.1 mol Cl-含有的核外电子总数为8 NA |
查阅资料可知,苯可被臭氧氧化,发生如下化学反应: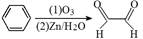 则二甲苯通过上述反应得到的产物有()种
则二甲苯通过上述反应得到的产物有()种
| A.1 | B.2 | C.3 | D.4 |
下列实验过程中曲线变化正确的是
A.①表示A. ①表示Na2CO3溶液中滴入稀盐酸
B.②表示溴水中滴入Na2SO3溶液
C.③表示AgNO3溶液中滴入氨水
D.④表示一定条件下2SO2+O2 2SO3达平衡后,升高温度
2SO3达平衡后,升高温度
海水是巨大的资源宝库,下列说法正确的是
| A.碘元素又称“海洋元素” |
| B.镁是海水中含量最多的金属元素 |
| C.从海水中提取食盐和碘的过程都是物理变化 |
| D.氯碱工业和纯碱工业的原料都有食盐 |
下列广告语对应商品中含有的物质有误的是
| A.“红梅味精,领先(鲜)一步 ”——蛋白质 |
| B.“衡水老白干,喝出男人味”——乙醇 |
| C.“吃了钙中钙,腰不疼了,腿不痛了,腰杆也直了”——碳酸钙 |
| D.“要想皮肤好,早晚用大宝”——丙三醇 |