精确配制一定物质的量浓度的NaO H溶液,下面实验操作中,正确的是
H溶液,下面实验操作中,正确的是
| A.称量时,将NaOH固体直接放在天平托盘上面的纸上 |
| B.将称好的NaOH固体放人容量瓶中,加入少量水溶解 |
| C.在烧杯中溶解NaOH固体后,立即将所得溶液注入容量瓶中 |
| D.将烧杯中已冷却的NaOH溶液转移到未经干燥的容量瓶中 |
下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在周期表中位置相符的一组是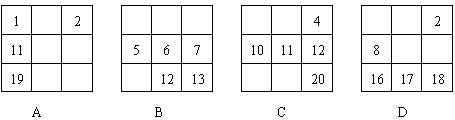
下列化学用语表达错误的是
A.S2—的结构示意图: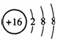 |
B.NH3的结构式: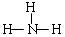 |
C.CO2分子的比例模型: |
D.CaCl2的电子式: |
天然气是植物残体在隔绝空气的条件下,经过微生物的发酵作用而逐渐形成的,因此天然气中所贮藏的化学能最初来自于
| A.化学能 | B.生物质能 | C.太阳能 | D.地热能 |
下列叙述正确的是
| A.一般来说,金属活动性越强的金属,人类大规模开发、利用的时间越早 |
| B.FeCl3溶液与Cu不会反应 |
| C.为减少高炉炼铁产生的污染,可以将烟囱造高一些 |
| D.根据酸碱质子理论,HCO3—也可归类为酸碱两性物质 |
节能减排是现阶段实现经济可持续发展的重大举措。下列举措不符合这一要求的是
| A.大力发展洁净煤燃烧技术和煤液化技术 |
| B.减少木材的使用,用聚苯乙烯生产包装盒、快餐盒 |
| C.农村大力发展沼气,将废弃的秸杆转化为清洁高效的能源 |
| D.推广使用乙醇汽油作汽车燃料 |