一定温度下,在体积为10L的密闭容器中,2molO2和2molSO2混合气体发生如下反应:2SO2(g)+ O2(g) 2SO3(g),半分钟后,体系中O2的物质的量变为1.4mol,则此反应的平均速率为
2SO3(g),半分钟后,体系中O2的物质的量变为1.4mol,则此反应的平均速率为
| A.v(O2) =" 0.002mol/(L•s)" | B.v(SO2) =" 0.002" mol/(L•s) |
| C.v(O2) =" 0.02" mol/(L•s) | D.v(SO3) =" 0.04" mol/(L•s) |
在一定温度不同压强(P1>P2)下,可逆反应2X(g)  2Y(g) + Z(g)中,生成物Z
2Y(g) + Z(g)中,生成物Z
在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是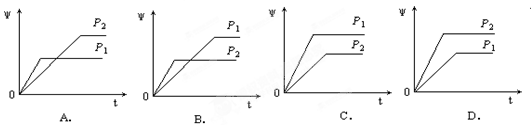
某学生的实验报告所列出的下列数据中合理的是
| A.用10mL量筒量取7.13mL稀盐酸 |
| B.用托盘天平称量25.20g NaCl |
| C.用广泛pH试纸测得某溶液的pH为2.3 |
D.用25mL滴定管做 中和滴定时,用去某浓度的碱溶液21. 中和滴定时,用去某浓度的碱溶液21. 70mL 70mL |
下图曲线a表示放热反应 X(g) + Y(g)  Z(g) + M(g) + N(s)△H <0进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z(g) + M(g) + N(s)△H <0进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是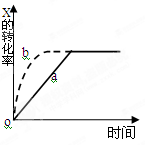
| A.升高温度 | B.加大X的投入量 |
| C.加催化剂 | D.增大体积 |
已知N2+3H2 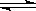 2NH3△H<O ,反应速率为V1;2HI
2NH3△H<O ,反应速率为V1;2HI 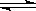 H2+I2△H>O ,反应速率为V2。对于上述两个可逆反应,当升高温度时,V1和V2的变化情况为
H2+I2△H>O ,反应速率为V2。对于上述两个可逆反应,当升高温度时,V1和V2的变化情况为
| A.同时增大 | B.同时减小 |
| C.V1增大,V2减小 | D.V1减小,V2增大 |
一定条件下反应2AB(g) A2(g) + B2(g)达到平衡状态的标志是
A2(g) + B2(g)达到平衡状态的标志是
A、容器内压强不随时间变化 B、容器内,3种气体AB、A2、B2共存
C、容器中各组分的体积分数不随时间变化 D、AB的消耗速率等于A2的消耗速率