反应2C + O2=2CO 的能量变化如右图所示。下列说法正确的是: ( )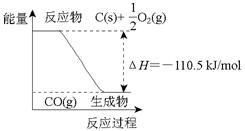
| A.12 g C(s)与一定量O2(g)反应生成14 g CO(g),放出的热量为110.5 kJ |
| B.该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差 |
| C.该反应的热化学方程式是2C(s) + O2(g)=2CO(g)ΔH=-221 kJ |
| D.2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ |
室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25 ℃其溶度积为2.8×10-9 mol2/L2,下列说法不正确的是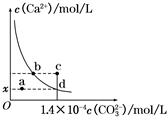
| A.x数值为2×10-5 |
| B.c点时有碳酸钙沉淀生成 |
| C.加入蒸馏水可使溶液由d点变到a点 |
| D.b点与d点对应的溶度积相等 |
如图甲池和乙池中的四个电极都是惰性材料,请根据图示判断下列说法正确的是
| A.两个装置之间没有盐桥,故不能形成电流 |
| B.a电极的电极反应式C2H5OH+16OH--12e-===2CO32-+11H2O |
| C.一段时间后,乙池d电极周围的溶液呈现棕褐色 |
| D.乙池在反应前后溶液的pH不变 |
充分燃烧一定量的丁烷气体放出的热量为Q,完全吸收它生成的CO2气体生成正盐,需5 mol·L-1的NaOH溶液100 mL,则丁烷的燃烧热为
| A.16Q | B.8Q | C.4Q | D.2Q |
在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:
CO(g)+H2O(g) H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为
| A.25% | B.50% | C.75% | D.80% |
常温下,有下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。下列有关说法正确的是
| A.四种溶液的KW相同,由水电离的c(H+):①=③>②=④ |
| B.向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>②>① |
| C.①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大 |
| D.将②、③两种溶液混合后,若pH=7,消耗溶液的体积为:③>② |