某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填如以下空格内,配平后标出电子转移的方向和数目。
(2)反应中,被还原的元素是 ,还原剂是 。
(3)纺织工业中常用氯气作漂白剂 ,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为 。
,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为 。
钨是高熔点金属,工业上用黑钨铁矿[(Fe,Mn)WO4]冶炼金属钨有多种方法,同时还可制得副产品高锰酸钾。已知WO3是钨的稳定氧化物,它不溶于水也不溶于酸,可用钨酸(H2WO4,黄色,不溶于水)或某些钨酸盐分解制得。其主要的工艺流程如下: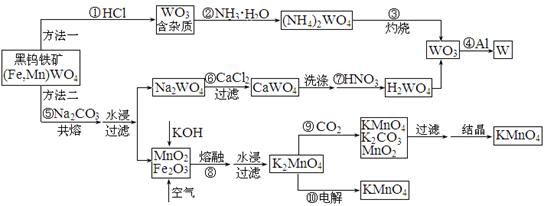
请根据图示及所学知识回答下列问题:
(1)写出反应④的化学方程式: ▲。
(2)写出反应⑨的离子方程式: ▲。
(3)方法二制WO3的过程中,需洗涤CaWO4,如何检验CaWO4已洗涤干净: ▲。
(4)整个工艺流程所涉及的物质中,属于酸性氧化物的有 ▲。
(5)写出反应⑩中阳极反应的电极反应式: ▲。
(14 分)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。以孔雀石为原料可制备CuSO4·5H2O及纳米材料G,步骤如下: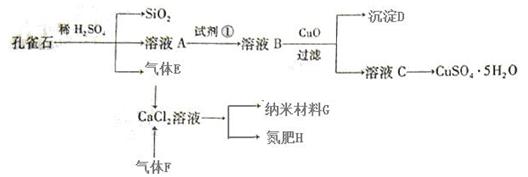
已知:
| 氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
| Fe3+ |
2.7 |
3.7 |
| Fe2+ |
7.6 |
9.6 |
| Cu2+ |
4.7 |
6.7 |
请回答下列问题:
(1)溶液A中含有Cu2+、Fe2+、Fe3+。根据上述实验过程,可作为试剂①的最合理的是 ▲(填代号)。
a.KMnO4b.(NH4)2S c.H2O2 d.KSCN
(2)向溶液B中加入CuO的作用是 ▲。
(3)由溶液C获得CuSO4·5H2O,需要经过 ▲操作。
(4)制备纳米材料G时,应向CaCl2溶液中先通入 ▲(填化学式)。写出该反应的化学方程式 ▲。
(5)欲测定溶液A中Fe2+的浓度,可取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,滴定时盛放待测液A的玻璃仪器是 ▲(填名称);滴定达到终点的现象为 ▲。
不对称烯烃与HX发生加成反应时HX中的H原子加成到含H较多的碳原子上。俄国化学家马科尼可夫因提出不对称烯烃的加成规则而著称于世。
又知:①CH3CH2Br+NaCN CH3CH2CN+NaBr
CH3CH2CN+NaBr
 ②CH3CH2CN
②CH3CH2CN
③CH3CH2COOH CH3CHBrCOOH
CH3CHBrCOOH
有下列有机物之间的相互转化:
回答下列问题:
(1)B→C的反应类型为;
(2)C→D、E→F的化学方程式为:
C→D ,
E→F(F为高分子时)。
(3)F可以有多种结构,写出下列情况下F的结构简式:
①分子式为C7H12O5,②分子内含有一个七元环。
工业上生产Na、Ca、Mg都用电解其熔融的氯化物,但钾却不能用电解熔融KCl的方法制得,因金属钾易溶于熔融态的KCl中而有危险,难获得钾,且降低电流效率。现生产钾是用属钠和熔化的KCl在一定的条件下反应制取: KCl + NaNaCl + K + Q (Q<0)
KCl + NaNaCl + K + Q (Q<0)
有关数据如下表:
| 熔点℃ |
沸点℃ |
密度(g/cm3) |
|
| Na |
97.8 |
882.9 |
0.97 |
| K |
63.7 |
774 |
0.86 |
| NaCl |
801 |
1413 |
2.165 |
| KCl |
770 |
1500(升华) |
1.984 |
(1) 工业上制取金属钾的化学原理是,在常压下金属钾转为气态从反应混合物中分离的最低温度约为,而反应的最高温度应低于。
(2)在制取金属钾的过程中,为了提高原料的转化率可采取的措施是。
(3)生产中常向反应物中通入一种气体,并将从反应器中导出的气体进行冷却得到金属钾,
且将该气体可循环利用,该气体是________。
a.干燥的空气 b.氮气 c.二氧化碳 d.稀有气体
(4)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为K=。
某反应体系中反应物与生成物有: K2SO4、CaSO4、MnSO4、CaC2O4、KMnO4、H2SO4、H2O和一种未知气体X。
(1)已知CaC2O4在反应中失去电子,则该反应的氧化剂是 。
(2)在标准状况下生成11.2LX时,有0.5mol 电子转移,共消耗0.25mol CaC2O4,X的化学式为 。
(3)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:
|
|
+