现有A、B、C、D、E五种强电解质,分别含有下列阴阳离子(离子不可重复)。
| 阴离子 |
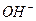 、 、 、 、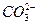 、 、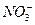 、 、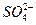 |
| 阳离子 |
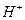 、 、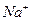 、 、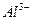 、 、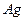 、 、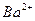 |
已知:①A、B两溶液呈碱性,C、D、E溶液呈酸性。
②A、E两溶液反应既有气体,又有沉淀生成,A、C两溶液反应只有气体产生。
③D与其他四种溶液反应,均产生沉淀,C只与D反应产生沉淀。
试回答下列问题:
(1)写出:①B的化学式 ,②D与A反应生成难溶物的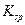 表达式 。
表达式 。
(2)A与E在溶液中反应的离子方程式为 。
(3)将pH相同的等体积A、B两种溶液稀释相同倍数后,溶液的pH关系是: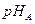
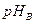 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)将C溶液逐滴加入到等体积、等物质的量浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为  。
。
(5)在100mL 0.1 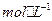 E溶液中,逐渐中入35 mL 2
E溶液中,逐渐中入35 mL 2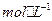
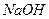 溶液
溶液 ,最终得到沉淀的物质的量为 mol。
,最终得到沉淀的物质的量为 mol。
X、Y、Z是三种常见的短周期元素,可以形成XY2、Z2Y、XY3、Z2Y2、Z2X等化合物。已知Y的离子和Z的离子有相同的电子层结构,X离子比Y离子多1个电子层。
(1)X离子的结构示意图为________。
(2)Z2Y对应水化物的碱性比LiOH________。
(3)Z2X属于________(填“共价”或“离子”)化合物。
(4)Z2Y2中含有________键和________键,Z2Y2溶于水时发生反应的化学方程式是__________________________________________________________________。
有5种短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化合物A2B,A2B中所有粒子的电子数相同,且电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
(1)用电子式表示离子化合物A2B的形成过程:__________________________________________________________________________。
(2)写出下列物质的电子式:
D元素形成的单质__________;B与E形成的化合物E2B__________;A、B、E形成的化合物__________;D、E形成的化合物__________。
为清理路面积雪人们使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
(1)该融雪剂的化学式是________,该物质中化学键类型是________,电子式是________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是________;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的结构式为________,电子式为________,化学键类型为________(填“离子键”“非极性共价键”或“极性共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成______,其化学键类型为________;加热时生成______,其化学键类型为________,电子式为________。
已知某物质主要成分的化学式为XY2,X原子的结构示意图为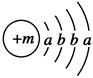 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m=________,该物质主要成分的化学式为________。
(2)Z、W元素的名称为________、________。
(3)下列说法正确的是________。
| A.XY2和WZ2都为离子化合物 |
| B.XY2分子中仅含离子键,WZ2中仅含极性共价键 |
| C.H2Z比HY的稳定性强 |
| D.X的阳离子比Y的阴离子半径大 |
(4)下列化学用语表达正确的是________。
(5)水的沸点比H2Z的沸点高,其原因是_________________________________________。
试分析下列各种情况下微粒间作用力的变化情况(填“离子键”“极性键”“非极性键”或“分子间作用力”):
①NaCl溶于水时破坏___________________________________;
②HCl溶于水时破坏____________________________________;
③SO2溶于水时破坏____________________________________;
④酒精溶于水时破坏____________________________________;
⑤NaOH和HCl反应时形成_______和_______;
⑥反应2H2+O22H2O中,被破坏的是________,形成的是________;
⑦CaCl2和Na2CO3反应时,被破坏的化学键有________,形成的化学键有________;
⑧Na2O熔化时被破坏的是________。