【化学——选修有机化学基础】
已知:一个碳原子上连有两个羟基时,易发生下列转化: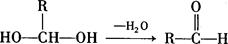
请根据下图作答: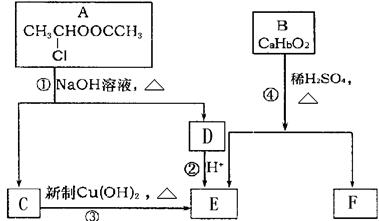
(1)A的核磁共振氢谱中出现 组峰;E中含有的官能团的名称是 。
(2)反应③的化学方程式为 。
(3)已知B的相对分子质量为162,其完全燃烧的产物中CO 2和H2O的物质的量之比为 n(CO2)︰n(H2O)=2︰1,则B的分子式为 。
(4)F是高分子光阻剂生产中的主要原料。F具有如下特点:
①属于芳香族化合物; ②能跟FeCl3溶液发生显色反应;
③能发生加聚反应; ④苯环上的一氯代物只有两种。
F在一定条件下发生加聚反应的化学方程式为 。
(5)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应。G可能有
种结构,写出其中不含甲基的同分异构体的结构简式 。
氢气燃烧生成液态水的热化学方程式是:
2H2(g)+O2(g) ===2H2O(l)ΔH=-572kJ/mol
请回答下列问题:
(1)生成物能量总和 (填“大于” 、“小于”或“等于”)反应物能量总和。
、“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气完全燃烧生成水蒸气,则放出的热量(填“>”、“<”或“=”)572 kJ。
(4分)下列六种物质的变化中,将合适序号填写在下列空白中:
①干冰的升华; ②硫酸钾熔化; ③NaCl溶于水; ④HCl溶于水; ⑤液氨的受热蒸发; ⑥Na2O2溶于水
(1)仅需要克服分子间作用力的是。(2)发生离子键破坏,又发生共价键破坏的是。(3)发生共价键破坏的是。(4)发生离子键破坏的是。
铁及铁的化合物在生产、生活中有着重 要的用途。
要的用途。
(1)聚合硫酸铁(简称PFS)的化学式为 [ Fe (OH)n(S04) (3-n) / 2 ]m,现代潜水处理工艺中常利用PFS在水体中形成絮状物 ,以吸附重金属离子。则PFS的中心原子未成对电子数为__个。
,以吸附重金属离子。则PFS的中心原子未成对电子数为__个。
(2)六氰合亚铁酸钾K4[Fe(CN)6]可用做显影剂,该化合物中存在的化学键类型有_____ ____ 。
____ 。
(3)CN一中碳原子的杂化轨道类型是 _______ :写出一种与CN一互为等电子体的分子的化学式________;
(4)三氯化铁常温下为固体,熔点304℃,沸点3160C 在3000C以上可升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为______晶体。
(5)普鲁士蓝是一种配合物,可用作染料,它的结构单元如下图所示,普鲁士蓝中 n(K+):n(Fe3+):n(Fe2+):n(CN一)= ________。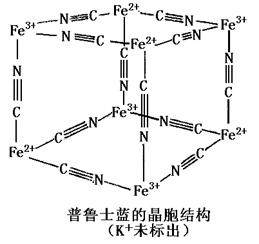
下表是元素周期表的一部分。表中所列字母分别代表一种化学元素。
| a |
|||||||||||||||||
| b |
c |
d |
e |
f |
|||||||||||||
| g |
h |
i |
j |
k |
l |
m |
|||||||||||
| n |
o |
 |
|||||||||||||||
试回答下列问题:
(1)请写出元素O的基态原子电子排布式。
(2)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表(填元素符号);其中电负性最大的是(填图中的序号),第一电离能最大的是(填图中的序号)。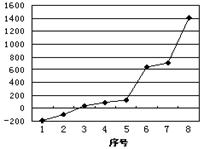
(3)由j原子跟c原子以1 : 1相互交替结合而形成的晶体,晶体类型与晶体j相同。两者相比熔点更高的是(填化学式),试从结构角度加以解释。
(4)COCl2俗称光气,分子中C原子采取杂化成键;分子中的共价键含有(填标号)
a.2个σ键b.2个π键c.1个σ键、2个π键d.3个σ键、1个π键
(16分)已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表。
| 元素 |
结构或性质信息 |
| X |
原子的L层上s电子数等于p电子数。 |
| Y |
原子核外的L层有3个未成对电子。 |
| Z |
在元素周期表的各元素中电负 性仅小于氟。 性仅小于氟。 |
| Q |
单质常温、常压下是气体,原子的M层上有1个未成对的p电子。 |
| R |
核电荷数是Y与Q的核电荷数之和 |
| E |
原子序数比R大3 |
请根据信息回答有关问题:
(1)元素Y的原子核外共有种不同运动状态的电子, 有种不同能级的电子。
有种不同能级的电子。
(2)X、Y、Z三种元素的第一电离能由高到低的排列次序依次为(写元素符号)。
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式)。
(4)R的核外电子排布式为。R的一种配合物的化学式为RCl3·6H2O。已知0.01 molRCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此配合物最可能是。
| A.[R(H2O)6]Cl3 | B.[R(H2O)5Cl]Cl2·H2O |
| C.[R(H2O)4Cl2]Cl·2H2O | D.[R(H2O)3Cl3]·3H2O |
(5)元素E能形成八面体构型的配合物离子[E (YH3) x Q 2]+,则中心原子为(写化学式),配位体为(写化学式),x 的值为。
(6) Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为。