含有11.2 g KOH的稀溶液与1 L 0.1 mol· L-1的H2SO4溶液反应放出11.46 kJ的热量,表示该反应的中和热的热化学方程式为( )
A.KOH(aq)+1/2H2SO4(aq) 1/2K2SO4(aq)+H2O(l);ΔH=-11.46 kJ· mol-1 1/2K2SO4(aq)+H2O(l);ΔH=-11.46 kJ· mol-1 |
B.2 KOH(aq)+H2SO4(aq) K2SO4(aq)+2H2O(l);ΔH=-114.6 kJ· mol-1 K2SO4(aq)+2H2O(l);ΔH=-114.6 kJ· mol-1 |
C.2KOH(aq)+H2SO4(aq) K2 K2 SO4(aq)+2H2O(l);ΔH=+114.6 kJ· mol-1 SO4(aq)+2H2O(l);ΔH=+114.6 kJ· mol-1 |
D.KOH(aq)+1/2H2SO4(aq) 1/2K2SO4(aq)+H2O(l);ΔH=- 1/2K2SO4(aq)+H2O(l);ΔH=- 57.3 kJ· mol-1 57.3 kJ· mol-1 |
下列有关物质的分类正确的是
| 酸性氧化物 |
一元酸 |
强电解质 |
分散系 |
|
| A |
Mn2O7 |
丙酸 |
三氧化二铝 |
黄河水 |
| B |
NO2 |
高氯酸 |
盐酸 |
有色玻璃 |
| C |
SiO2 |
石炭酸 |
氢氧化铝 |
云、雾 |
| D |
SO2 |
硝酸 |
溴化氢 |
冰水混合物 |
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.2.0gH218O与D2O的混合物中所含中子数为NA |
| B.1 mol氢氧化铁胶粒所含氢氧化铁的分子数为NA |
| C.标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA |
| D.足量的Fe和1mol Cl2完全反应,转移的电子数为3NA |
下列有关实验的选项正确的是
| A.配制0.10mol/L NaOH溶液 |
B.观察Fe(OH)2的生成 |
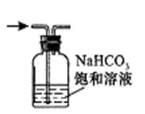
C.除去氯气中的氯化氢 |
D.记录滴定终点读数为12.20mL |
 |
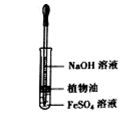 |
 |
 |
下列说法正确的是
①非金属氧化物一定是酸性氧化物
②依据丁达尔现象可将分散系分为溶液、胶体与浊液
③利用金属钠可区分乙醇和乙醚
④碱性氧化物一定是金属氧化物
⑤某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体,说明该钾盐是K2CO3
⑥欲配制1L1.00mol/L的KCl溶液,可将74.5gKCl溶于1L水中
⑦质子数、中子数和电子数都相同的粒子一定是同一种粒子。
| A.全部 | B.①②③④⑦ | C.①②④ | D.③④ |
下列我国古代的技术应用中,其不涉及化学反应的是
| A火药使用 |
B粮食酿酒 |
C活字印刷 |
D造纸技术 |
 |
 |
 |
 |