有铁的氧化物样品.用5 mol·L一盐酸140ml,恰好使其完全溶解,所得溶液还能吸收标准状况下0.56 L氯气,使其中的Fe2+部转化为Fe3+,该样品可能的化学式是 ( )
| A.Fe2O3 | B.Fe3O4 | C.Fe4O5 | D.Fe5O7 |
已知化学反应2C(s)+O2(g) 2CO(g),2CO(g)+O2(g)
2CO(g),2CO(g)+O2(g) 2CO2(g)都是放热反应,据此判断,下列说法中不正确的是(其他条件相同)()
2CO2(g)都是放热反应,据此判断,下列说法中不正确的是(其他条件相同)()
| A.12 g碳所具有的能量一定高于28 g CO所具有的能量 |
| B.56 g CO和32 g O2所具有的总能量大于88 g CO2所具有的总能量 |
| C.12 g C和32 g O2所具有的总能量大于44 g CO2所具有的总能量 |
| D.将一定质量的C燃烧,生成CO2比生成CO时放出的热量多 |
在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是()
A.CH3OH(l)+ O2(g)====CO2(g)+2H2O(l) ΔH="+725.8" kJ·mol-1 O2(g)====CO2(g)+2H2O(l) ΔH="+725.8" kJ·mol-1 |
| B.2CH3OH(l)+3O2(g)====2CO2(g)+4H2O(l) ΔH="-1" 452 kJ·mol-1 |
| C.2CH3OH(l)+3O2(g)====2CO2(g)+4H2O(l) ΔH="-725.8" kJ·mol-1 |
| D.2CH3OH(l)+3O2(g)====2CO2(g)+4H2O(l) ΔH="+1" 452 kJ·mol-1 |
沼气是一种能源,它的主要成分是CH4,0.5 mol CH4完全燃烧生成CO2和液态H2O时,放出445 kJ的热量,则下列热化学方程式正确的是()
| A.2CH4(g)+4O2(g)====2CO2(g)+4H2O(l) ΔH="+890" kJ·mol-1 |
| B.CH4(g)+2O2(g) ====CO2(g)+2H2O(l) ΔH="+890" kJ·mol-1 |
| C.CH4(g)+2O2(g) ====CO2(g)+2H2O(l) ΔH="-890" kJ·mol-1 |
D.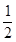 CH4(g)+2O2(g)==== CH4(g)+2O2(g)====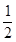 CO2(g)+2H2O(l) ΔH="-890" kJ·mol-1 CO2(g)+2H2O(l) ΔH="-890" kJ·mol-1 |
下列说法不正确的是()
| A.物质发生化学反应的反应热仅指反应放出的热量 |
| B.热化学方程式中各物质的化学计量数只表示物质的量,不表示分子的个数 |
| C.所有的燃烧都是放热反应 |
| D.热化学方程式中分子式前面的化学计量数可以是分数 |
下列变化,属于吸热过程的是()
| A.浓H2SO4溶于水 | B.甲烷燃烧 |
| C.CaO与水反应 | D.Ba(OH)2晶体与NH4Cl反应 |