下列是某学生总结的一些规律,其中正确的是
| A.氧化物不可能是还原产物,只可能是氧化产物 |
| B.有些化学反应不属于化合、分解、置换、复分解中的任何一种反应 |
| C.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物 |
D.将Mg(HCO3)2溶液加热,最终得到Mg(OH)2沉淀,由此可知 sp[Mg(OH)2] > sp[Mg(OH)2] > sp(Mg CO3) sp(Mg CO3) |
某烃分子中有40个电子,它燃烧时生成等体积的CO2和H2O(g),该有机物的分子式为()
| A.C4H8 | B.C4H10O | C.C5H10 | D.C4H10 |
甲烷与两种气态烃所组成的混合物,其平均相对分子质量为25.33。取该气体混合物1 L,完全燃烧需相同条件下O2 3 L,则两种气态烃可能为()
| A.C2H6和C3H8 |
| B.C2H4和C2H6 |
| C.C3H4和C3H6 |
| D.C3H6和C4H8 |
某气态烃的组成中碳元素的质量分数为81.8%,其密度是相同条件下氢气密度的22倍,则该烃的分子式为()
| A.C2H6 | B.C3H6 | C.C3H8 | D.C4H8 |
某烃中碳和氢的质量比是24∶5,该烃在标准状况下的密度是2.59 g·L-1,其分子式为()
| A.C2H6 | B.C4H10 | C.C5H8 | D.C7H8 |
下列卤代烃中沸点最低的是()
| A.CH3—CH2—CH2—Cl |
B.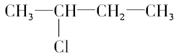 |
| C.CH3—CH2—CH2—Br |
D.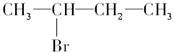 |