(8分)如图所示,在一条鱼、虾几乎绝迹的河边,从上游到下游依次有甲、乙、丙、丁四座工厂,各厂排放的废水里都只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种。某中学环保小组对河水检测时发现:①甲处河水呈乳白色;②乙处河水呈红褐色;③丙处河水由浑变清;④丁处产生气泡,河水仍澄清。请回答:
(1)四座工厂排出的废水里含有的污染物分别为:
甲: 乙: 丙: 丁: (填化学式)
(2)在丁的下游M处取出的河水中,肯定含有的离子是 。
(3)写出有关反应的离子方程式:
。
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Na+、K+、Cu2+ |
| 阴离子 |
SO42—、OH— |
如图1中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了16g。常温下各烧杯中溶液的pH与电解时间t的关系如图2。据此回答下列问题:
(1)电极b上发生的电极反应为 。
(2)写出乙烧杯的电解池总反应化学方程式 。
(3)用惰性电极电解B溶液,当阳离子浓度下降至一半时停止通电,加入下列物质不能使该溶液恢复至起始状态的是 。
A、Cu2O B、CuO C、Cu(OH)2D、CuCO3
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行 (填“能”或“不能”)。
(5)计算电极e上生成的气体在标准状态下的体积 。
(6)要使丙烧杯溶液恢复到原来的状态,操作是 。
工业上用某矿渣(主要成分是Cu2O,少量杂质是Al2O3、Fe2O3和SiO2)提取铜的操作流程如下: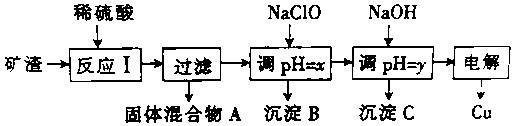
已知:Cu2O+2H+==Cu+Cu2++H2O
| 沉淀物 |
 |
 |
 |
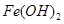 |
| 开始沉淀pH |
5.4 |
4.0 |
2.2 |
5.8 |
| 沉淀完成pH |
6.7 |
5.2 |
3.2 |
8.8 |
(1)固体混合物A中的成分是 (填化学式)。
(2)反应I完成后,铁元素的存在形式为 (填离子符号)。
(3)y的数值范围是 。
(4)若电解法获得Cu 64.0g,则原矿渣中Cu2O的质量是 。
a、144.0gb、大于144.0gc、小于144.0g
(5)下列关于用NaClO调节溶液pH的说法正确的是 。
a、加入NaClO可使溶液的pH降低
b、NaClO能调节pH的主要原因是由于发生反应: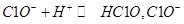 消耗H+,从而达到调节pH的目的
消耗H+,从而达到调节pH的目的
c、NaClO能调节pH的主要原因是由于NaClO水解: OH—消耗H+,从而达到调节pH的目的。
OH—消耗H+,从而达到调节pH的目的。
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,且该物质与还原产物的物质的量之比为4:1,该反应的离子方程式为 。
已知由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示,B、X为单质,D常温下为无色液体,A、B含同一种元素。(某些产物可能略去)
请回答下列问题:
(1)若E是有色气体,F是一元强酸,反应①是工业制备F的第一步反应。
①写出A与X反应的化学方程式: 。
②A的分子结构模型为 。
③已知常温下46g气体E发生反应③放出46kJ热量,写出气体E与H2O反应的热化学方程式 。
④在常温下,向V1LpH=a的A溶液中加入V2LpH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则V1和V2的关系为V1 V2(填 无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是 。(写出一种情况即可)
无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是 。(写出一种情况即可)
(2)若E为无色无味气体,F是二元弱酸。
①E的电子式为 ;
②将少量气体E通入氢氧化钡溶液中得不溶物H,H的Ksp=8.1×10—9。现将该沉淀放入0.1mol/L的BaCl2溶液中,其Ksp ,(填:增大、减小或不变),此时,组成不溶物H的阴离子在溶液中的浓度为 mol/L。
已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且 的值与温度高低有关.当n(KOH)="a" mol时,
的值与温度高低有关.当n(KOH)="a" mol时,
(1)标准状况下,参加反应的氯气的体积等于 L
(2)若某温度下,反应后 ,则溶液中
,则溶液中 = ,此时反应总离子方程式为 .
= ,此时反应总离子方程式为 .
(3)改变温度,产物中KClO3的最大理论产量为 mol.
某无色溶液的溶质只由以下离子中的若干离子构成:Na+、Ag+、Ba2+、Al3+、AlO2﹣、CO32﹣、SO42﹣.将该溶液进行如下实验,根据所给实验现象判断原溶液中离子的存在情况,填写空格.
(1)取适量该溶液,加入过量盐酸,有气体生成,最终得到无色透明溶液.肯定存在的离子 ;肯定不存在的离子 .
(2)在(1)所得到的溶液中再加入过量NH4HCO3溶液,有无色无味的气体生成,同时析出白色沉淀.原溶液中肯定存在的离子 ,写出生成沉淀的离子方程式 .
(3)在(2)所得溶液中加入过量Ba(OH)2溶液,加热,有刺激性气味的气体生成,同时析出白色沉淀.沉淀中一定含有
(4)原溶液中溶质的成分为 (填写化学式)