(8分)A、B、C、D为四种可溶性的盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是NO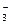 、SO
、SO 、Cl-、CO
、Cl-、CO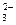 的中的一种。
的中的一种。
①若把四种盐分别溶解于盛有蒸气水的四支试管中,只有C盐的溶液呈蓝色。
②若向①的四支试管中分别加入盐酸,B盐的溶液有沉淀生成,D盐的溶液有无色无味的气体逸出。
根据①②实验事实可推断它们的化学式为:
(1)A ,C
(2)写出盐酸与D反应的离子反应方程式:
(3)写出C与Ba(OH)2溶液反应的离子方程式
(1)①根据图示,写出反应的热化学方程式:。
②根据如图所示情况,判断下列说法中正确的是()
| A.其热化学方程式为:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=+41 kJ/mol |
| B.该反应为吸热反应 |
| C.该反应为放热反应 |
| D.当H2O为液态时,其反应热值小于41 kJ/mol |
(2)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是。
(3)如图是某温度下,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为:。
a、b两条曲线产生区别的原因很可能是。
、根据电离平衡移动原理完成下列表格
(1)已知:CH3COOH为弱电解质,在醋酸溶液中,当改变条件后,完成表格中的变化情况
| 外加条件 |
平衡移动方向 |
C(OH -) |
C(CH3COO -) |
| 升温 |
不填 |
不填 |
|
| 加水 |
不填 |
||
| 加盐酸 |
不填 |
||
| 加少量氢氧化钠固体 |
不填 |
不填 |
(2)在一定温度下,冰醋酸加水稀释过中溶液的导电能力如下图所示,请回答:
①写出醋酸的电离方程式________________。
②a、b、c三点溶液中氢离子浓度由小到大的顺序为__________________ 。
③a、b、c三点中醋酸的电离程度最大的是。
④取甲、乙两份等体积c点的溶液,甲用蒸馏水稀释10倍,,乙用蒸馏水稀释100倍,则稀释后甲、乙两溶液中的H+浓度:C(H+)甲_____ 10C(H+)乙(填“大于”、“小于”或 “等于”),
根据强弱电解质的概念回答下列问题:
其中能够导电的是;属于强电解质的是;属于弱电解质的是;属于非电解质的是(注回答不全不给分)
从铝土矿(主要成分是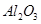 ,含
,含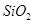 、
、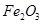 、MgO等杂质)中提取Al2O3的两种工艺品流程如下:
、MgO等杂质)中提取Al2O3的两种工艺品流程如下: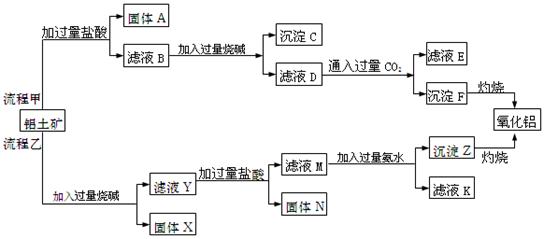
请回答下列问题:
(1)写出相应物质的的化学式:固体A,固体N,
滤液D中溶质为。
(2)流程甲加入盐酸后生成Al3+的离子方程式为。
(3)流程乙加入烧碱后生成水玻璃溶液的化学方程式为。
某金属A及其化合物之间有如下的转化关系: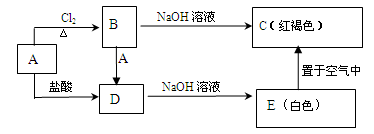
试回答下列问题:
(1)D的溶液与NaOH 溶液混合后的现象是
。
(2)反应B转化成D的离子方程式是。
(3)把B溶液滴入沸水中可以得到红褐色的液体,用一束光通过该液体产生。