(1)1.00L1.00mol/LH2SO4溶液与2.00L1.00mol/LNaOH溶液完全反应,放出114.6kJ的热量,表示其中和热的热化学方程式为 。
(2)由金红石(TiO2)制取单质Ti,涉及到的步骤为: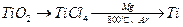
已知:①C(s) + O2(g) = CO2(g);ΔH=-393.5kJ/mol
②2CO(g) + O2(g) = 2CO2(g);ΔH=-566kJ/mol
③TiO2(s) + 2Cl2(g) = TiCl4(s)+O2(g);ΔH=+141kJ/mol
2Cl2(g) = TiCl4(s)+O2(g);ΔH=+141kJ/mol
则a.碳在氧气中不完全燃烧生成CO的热化学方程式为
。
b.TiO2(s) + 2Cl2(g) + 2C(s) = TiCl4(s) + 2CO(g)的ΔH=________________。
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: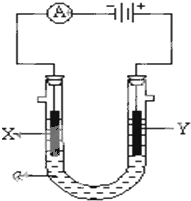
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为.
②Y电极上的电极反应式为,
③该反应的总反应方程式是:﹣
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是,电极反应式是.
②Y电极的材料是,电极反应式是.
(3)若a为CuSO4溶液,则电解时的化学反应方程式为、通过一段时间后,向所得溶液中加入0.2molCu(OH)2粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为.
(4)若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672mL(标准状况下)时,溶液的C(H+)=(假设电解后溶液体积不变).
氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高.
(1)若电解质溶液为KOH溶液,其正极反应为,负极反应为﹣;
(2)若电解质溶液为硫酸,其正极反应为,负极反应为;若反应过程中转移了2mol电子,可产生水的质量为g.
(3)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中c(Na+)=3c(Cu2+)=0.3mol•L﹣1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112L(标准状况)气体.此时氢氧燃料电池外电路中转移电子数为,消耗H2的质量为g.
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).
(1)丙烷脱氢可得丙烯. 已知:C3H8(g)═CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJ•mol﹣1
CH3CH=CH2(g)═CH4(g)+HC≡CH(g)△H2=32.4kJ•mol﹣1则相同条件下,反应C3H8(g)═CH3CH=CH2(g)+H2(g)的△H=kJ•mol﹣1
(2)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.已知:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ•mol﹣1CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4kJ•mol﹣1
2H2S(g)=2H2(g)+S2(g)△H=+169.8kJ•mol﹣1以甲烷为原料制取氢气是工业上常用的制氢方法.CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为.
(3)铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛.真空碳热还原﹣氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g)△H="a" kJ•mol﹣13AlCl(g)=3Al(l)+AlCl3(g)△H="b" kJ•mol﹣1反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=kJ•mol﹣1(用含a、b的代数式表示).
(1)下列各种情况,在其中Fe片腐蚀由快到慢的顺序是.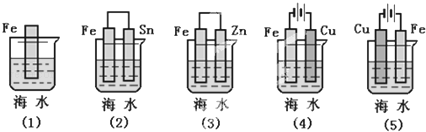
(2)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀.在空气酸度不大的环境中负极反应式为;正极反应式为.
完成下列计算
(1) 相同物质的量的O2和O3的质量比____,分子个数比为______,所含氧原子的个数比为_______.
(2) 在200 mL 2 mol/L MgCl2溶液中,溶质的质量为________.此溶液中Mg2+的物质的量浓度为___________,Cl-的物质的量浓度为________.
(3) 在质量分数为28%的KOH水溶液中,OH-与H2O数目之比是________.