(1)电解原理在化学工业中有广泛的应用。现将你设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y是两块电极扳,则
①若X和Y均为惰性电极,a为饱和食盐水,则电解时检验Y电极反应产物的方法是 。
②若X、Y分别为石墨和铁,a仍为饱和的NaCl溶液,则电解过程中会生成白色固体,发生的总反应化学方程式为
。
该白色固体露置在空气中,可观察到的现象是
。
③若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电后,发生的总反应化学方程式为 。通电一段时间后,向所得溶液中加入0.05 mol Cu(OH )2,恰好恢复电解前的浓度和pH,则电解过程中电子转移的物质的量为 mol。
)2,恰好恢复电解前的浓度和pH,则电解过程中电子转移的物质的量为 mol。
(2)利用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K2SO4溶液。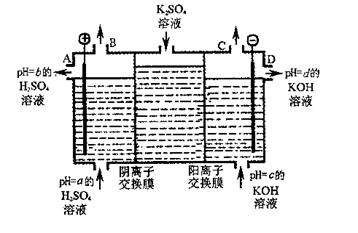
①该电解槽的阳极反应式为 ,通过阴离子交换膜的离子数 (填“>”、“<”或“=”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为 ;
③电解一段时间后,B口与C口产生气体的质量比为 。
A、B、C均为短周期元素,可形成A2C和BC2两种化合物。A、B、C的原子序数依次递增,A原子的K层的电子数目只有一个,B位于A的下一周期,它的最外层电子数比K层多2个,而C原子核外的最外层电子数比次外层电子数少2个。它们的元素符号分别为:A;B;C;BC2是由键组成的(填“极性”或“非极性”)分子。
溴化碘(IBr)的化学性质类似于卤素单质,试回答下列问题:
(1)溴化碘的电子式是,它是由键形成的分子。
(2)溴化碘和水反应生成了一种三原子分子,该分子的电子式为。
硫化氢(H2S)分子中,两个H—S键的夹角接近90°,说明H2S分子的空间构型为;二氧化碳(CO2)分子中,两个C=O键的夹角是180°,说明CO2分子的空间构型为;甲烷(CH4)分子中,两个相邻C—H键的夹角是109°28′,说明CH4分子的空间构型为。
根据下列要求,各用电子式表示一实例:
(1)、只含有极性键并有一对孤对电子的分子
(2)、只含有离子键、极性共价键的物质
(3)、只含有极性共价键、常温下为液态的非极性分子
请指出表中分子的空间构型,判断其中哪些属于极性分子,哪些属于非极性分子,并与同学讨论你的判断方法。
| 分子 |
空间构型 |
分子有无极性 |
分子 |
空间构型 |
分子有无极性 |
| O2 |
HF |
||||
| CO2 |
H2O |
||||
| BF3 |
NH3 |
||||
| CCl4 |