设nA为阿伏加德罗常数的值,下列叙述正确的是 ( )
| A.常温常压下,16g14CH4所含中子数目为8nA |
| B.标准状况下,22.4 LCCl4所含分子数目为nA |
| C.1 L 0.5 mol·L-1的CH3COONa溶液中所含的CH3COO-离子数目为0.5n |
| D.6.2g白磷(分子式为P4,分子结构如右图所示)所含P-键数目为0.3nA |

下列有机物命名正确的是( )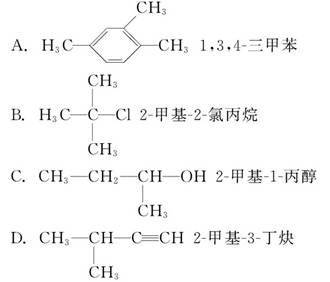
鲨鱼是世界上唯一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌性。已知角鲨烯分子中含有30个碳原子及6个C=C且不含环状结构,则其分子式为()
| A.C30H60 | B.C30H56 | C.C30H52 | D.C30H50 |
某炔烃氢化后得到的饱和烃是: ,该烃可能的结构有( )
,该烃可能的结构有( )
| A.1种 | B.2种 | C.3种 | D.4种 |
下列说法中错误的是( )
①化学性质相似的有机物是同系物
②分子组成相差一个或几个CH2原子团的有机物是同系物
③若烃中碳、氢元素的质量分数相同,它们必定是同系物
④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似
| A.①②③④ | B.只有②③ | C.只有③④ | D.只有①②③ |
有一类最简单的有机硅化合物叫硅烷,它的分子组成与烷烃相似。下列说法中错误的是( )
| A.硅烷的分子通式为SinH2n+2 | B.甲硅烷燃烧生成二氧化硅和水 |
| C.甲硅烷的密度大于甲烷 | D.甲硅烷的热稳定性强于甲烷 |