氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,熔点422℃,沸点1366,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42-等杂质、Cu、稀硫酸、SO2等为原料合成CuCl的工艺如下:
(1)A的化学式为 。
(2)写出反应V的化学方程式 。
(3)写出反应VI的离子方程式为 。
(4)本工艺中可以循环利用的物质是(刚化学式表示) 。
(5)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是 。
氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得:
SiO2+C+N2 Si3N4+CO
Si3N4+CO
根据题意完成下列各题:
(1)配平上述化学反应方程式。
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了20mol氮气,反应生成了5mol一氧化碳,此时混合气体的平均相对分子质量是。
(3)分析反应可推测碳、氮气的氧化性:CN2(填“>”“<”“=”)。
(4)氮化硅陶瓷的机械强度高,硬度接近于刚玉(A12O3),热稳定性好,化学性质稳定。以下用途正确的是。
| A.可以在冶金工业上制成坩埚、铝电解槽衬里等设备 |
| B.在电子工业上制成耐高温的电的良导体 |
| C.研发氮化硅的全陶发动机替代同类型金属发动机 |
| D.氮化硅陶瓷的开发受到资源的限制,没有发展前途 |
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比C12、O2、C1O2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:
2FeSO4 + a Na2O2 = 2Na2FeO4 + b X + 2Na2SO4 +c O2↑
①该反应中物质X应是,a与c的关系是。
②简要说明K2FeO4作为水处理剂时,在水处理过程中所起的作用
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、C1O-、OH-、FeO42-、C1-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:。
②每生成1mol FeO42-转移mo1电子,若反应过程中转移了0.3mo1电子,则还原产物的物质的量为mo1。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题。
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:
CO(g) + 2H2(g)  CH3OH(g)。
CH3OH(g)。
⑴该反应的平衡常数表达式为 K = ___________________________。
⑵如图是该反应在不同温度下CO的转化率随时间变化的曲线。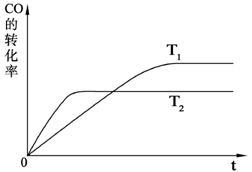
①该反应的焓变△H _____0(填“>”、“<”或“=”)。
②若容器容积不变,下列措施可增加甲醇产率的是_________。
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.使用合适的催化剂 | D.充入He,使体系总压强增大 |
⑶已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)△H=-a kJ·mol-1
② 2CO(g) + O2(g) = 2CO2(g)△H=-b kJ·mol-1
③ H2O(g) = H2O(l)△H=-c kJ·mol-1
则CH3OH(l) + O2(g) =" CO(g)" + 2H2O(l)△H= ____________________ kJ·mol-1。
在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g)△H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g)△H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题: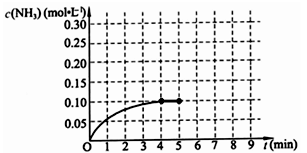
⑴根据上图,计算从反应开始到平衡时,平均反应速率v(NH3)=_________________。
⑵该反应450℃的平衡常数________500℃时的平衡常数(填“>”、“<”或“=”)。
⑶下列描述中能说明上述反应已达平衡的是___________。
| A.3v正(H2)=2v逆(NH3) |
| B.容器中气体的平均相对分子量不随时间而变化 |
| C.容器中气体的密度不随时间而变化 |
| D.容器中气体的分子总数不随时间而变化 |
⑷第5分钟末,保持恒温恒压,若继续通入0.2mol的N2和0.6mol的H2,平衡_______________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
⑸第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3浓度约为0.25mol/L),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
过氧化氢(H2O2)是一种无色粘稠液体,它的水溶液俗称双氧水,呈弱酸性,常用作无公害的消毒杀菌剂和漂白剂等。
⑴下列说法正确的是_________
| A.过氧化氢分子中既有极性键又有非极性键 | B.H2O2与H2O互为同素异形体 |
| C.34g H2O2中含有的阴离子数为NA | D.实验室可以利用过氧化氢制取氧气 |
⑵ H2O2是一种二元弱酸,请写出它的第二步电离方程式:_____________________。
⑶将H2O2溶液加入酸性FeCl2溶液中,溶液由浅绿色变为棕黄色,写出该反应的离子方程式:_____________________________________。
⑷某厂工业废水中含有一定量氯气,为了除去氯气,常加入H2O2作脱氯剂,写出该反应的化学方程式:__________________________________________。