硫酸铜是一种重要的化工原料,工业上常用硫酸为原料来制备硫酸铜。
(1)工业上生产硫酸过程中,焙烧硫铁矿时产生的废渣是一种二次资源。
①为了从废渣中磁选获得品位合格的铁精矿,高温下利用CO使弱磁性Fe2O3转化为强磁性Fe3O4。写出该反应的化学方程式 ;实验发现:CO太多或太少都会导致磁铁矿产率降低,原因是 。
②氯化焙烧工艺是将废渣用氯化钙水溶液调和、成球、高温焙烧,废渣中SiO2与CaCl2等在高温下反应放出HCl,HCl与金属氧化物等反应生成氯化物。反应生成的各金属氯化物以气态形式逸出,进而回收有色金属和回返氯化钙溶液。写出氯化焙烧工艺中生成HCl的化学方程式 。
(2)测定硫酸铜品体中结品水含量的实验步骤为:
步骤1:准确称量一个洁净、干燥的坩埚;
步骤2:将一定量的硫酸铜晶体试样研细后,放入坩埚中称重
步骤3:将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
步骤4:将步骤3中的坩埚放入干燥器,冷却至室温后,称重:
步骤5: ;
步骤6:根据实验数据计算硫酸铜晶体试样中结晶水的质量分数。
请完成实验步骤5。
(3)已知硫酸铜品体受热可以逐步失去结品水,温 度升高还町以分解生成铜的氧化物。观取25.0g CuSO4·5H2O品体均匀受热,缓慢升温至1200℃并恒温1小时,实验测得固体残留率(剩余固体的质量/原始固体质量)与温度的关系如下图所示:
度升高还町以分解生成铜的氧化物。观取25.0g CuSO4·5H2O品体均匀受热,缓慢升温至1200℃并恒温1小时,实验测得固体残留率(剩余固体的质量/原始固体质量)与温度的关系如下图所示: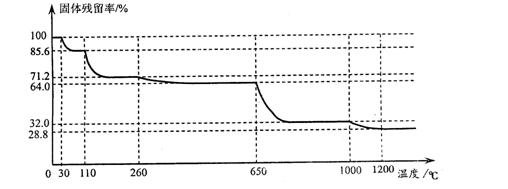
在110℃时所得固体的成分为 ;在1200℃并恒温1小时,反应所 得气态产物除去水后,物质的量为 。(填字母)
得气态产物除去水后,物质的量为 。(填字母)
| A.0 mol | B.0.1mol | C.0.125mol | D.大于0.125mol |
(7分)茉莉花香气的成分有多种, 是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
⑴写出反应①的化学方程式:_______________________________。
⑵反应③的反应类型为___________________。
⑶C通常有三种不同类别的芳香族同分异构体,试写出另两种不同类别的同分异构体的结构简式(各写一种) 、
某芳香族酯类化合物甲的分子式为C14H10O5,1mol甲在酸性条件下水解后只生成一种产物乙,其物质的量为2mol,乙分子内苯环上只有两个邻位取代基。回答下列问题:
(1)写出有机物乙的结构简式。
(2)写出有机物甲和足量NaOH溶液反应的化学方程式。
(3)按下列要求写出和乙有不同 取代基的乙的同分异构体
取代基的乙的同分异构体
①苯环上有两个取代基。(写一种即可)
②苯环上有三个取代基。(写一种即可)
2008年北京残奥会吉祥物是以牛为形象设计的“福牛乐乐”(Funiulele)。有一种有机物的键线式也酷似牛形(下图所示) ,故称为牛式二烯炔醇(cowenyenynol)。回答下列有关该物质的问题:
,故称为牛式二烯炔醇(cowenyenynol)。回答下列有关该物质的问题: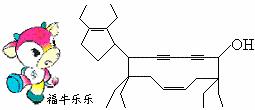
(1)“牛身”是由个碳原子形成的碳环。
(2)1 mol牛式二烯炔醇最多可跟mol Br2发生加成反应。
(3)该物质能否在浓硫酸、加热的条件下发生消 去反应?
去反应?
当甲烷的四个氢被甲基替换后,得到新戊烷,新戊烷的所有氢原子再被甲基替换得到新的烷烃,……
(1)请写出甲烷电子式。(2)请将新戊烷用系统命名法命名。
(3)试写出甲烷按上述方法连续进行三次甲基替换操作后所得烷烃的分子式
下列各组物质属于同系物的是,属于同分异物体的是;属于同位素的是 ,属于同素异形体的是,属于同一种物质的是。(填序号)
⑴O2和O3⑵氕和氚 ⑶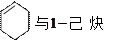 ⑷苯和对二甲苯
⑷苯和对二甲苯
⑸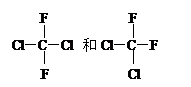 ⑹
⑹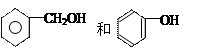 ⑺
⑺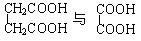
⑻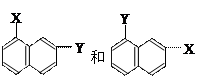 ⑼
⑼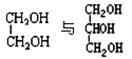 (10) 乙醇和乙醚
(10) 乙醇和乙醚