1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。臭氧分子的结构如图,呈V型,两个O-O键的夹角为116.5º,三个原子以一个O原子为中心,与另外两个氧原子分别构成共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学健―三个O原子均等地享有这4个电子。(如右图所示)。请回答:

(1)臭氧与氧气的关系是______________。
(2)选出下列分子与O3分子的结构最相似的是( )
| A.H2O | B.CO2 | C.SO2 | D.BeCl2 |
(3)分子中某原子没有跟其他原子共用的价电子对叫孤对电子,那么O3分子有 对孤对电子。
(4)O3具有强氧化性,它能氧化PbS为PbSO4,而O2不能,试配平:
_____PbS + _____O3 ——_____PbSO4 + _____O2;
(1)下列物质:①CO2②盐酸③烧碱晶体④酒精⑤铁⑥纯 醋酸(用编号回答)其中属于电解质的有;属非电解质的是。
醋酸(用编号回答)其中属于电解质的有;属非电解质的是。
(2)按要求写出下列反应的离子方程式:
①铁和盐酸反应:______________________________________
②CuSO4和Ba(OH)2反应:
(1)某含碳、氢、氧三种元素的有机物,其碳、氢、氧的质量比为6:1:8,它的实验式为__________;该有机物蒸气的密度是相同条件下氢气密度的30倍,则该有机物的分子式为_______________。
(2)据报道,2002年10月26日俄罗斯特种部队在解救人质时,使用了一种麻醉作用比吗啡强100倍的氟烷,已知氟烷的化学式为C2HClBrF3,则沸点不同的上述氟烷有4种,它们的结构简式分别是:
有的油田开采的石油中溶有一种碳氢化合物——金刚烷,它的分子立体结构如图所示: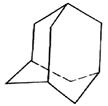
(1)由图可知其分子式为:____________。
(2)它是由_________ 个六元环构成的六体的笼状结构,其中有__________个碳原子为三个环共有。
(3)金刚烷分子 的一氯代物有_______种;二氯代物有种。
的一氯代物有_______种;二氯代物有种。
写出下列基团的电子式:
|
①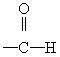 ___________________②─C≡C─________________
___________________②─C≡C─________________
由分子式及核磁共振氢谱写出该有机物的结构简式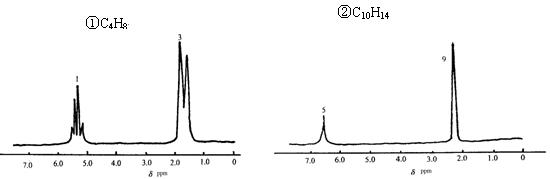
①结构简式:________________________②结构简式:________________________