下列关于实验原理或操作的叙述中,正确的 是 ( )
是 ( )
| A.用无水乙醇从碘水中提取单质碘 |
B.稀释浓 硫酸时,应将浓硫酸缓缓注入盛有水的量筒中 硫酸时,应将浓硫酸缓缓注入盛有水的量筒中 |
| C.配制.FeCl3溶液时,向溶液中加入少量Fe和稀盐酸 |
| D.提纯混有少量乙酸的乙醇,可先加生石灰再蒸馏 |
下列离子方程式正确的是
A.0.01mol NH4Al(SO4)2溶液与0.01mol·L-1Ba(OH)2溶液等体积混合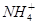 +Al3++2 +Al3++2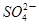 +2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O +2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O |
B.Na2S2O3溶液中加入稀硫酸: +4H+= +4H+=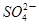 +3S↓+2H2O +3S↓+2H2O |
| C.将标准状况下的11.2L氯气通入200mL2mol·L-1的FeBr2溶液中,离子反应方程式为:4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl- |
D.铁粉中滴加少量浓硝酸:Fe+3 +6H+=Fe3++3NO2↑+3H2O +6H+=Fe3++3NO2↑+3H2O |
下列各组离子一定能大量共存的是
A.在含大量Fe3+的溶液中: 、Na+、Cl-、SCN- 、Na+、Cl-、SCN- |
B.在含有大量Al3+、Cl-的溶液中: 、I-、 、I-、 、Mg2+ 、Mg2+ |
C.在氨水溶液中:Ba2+、Cu2+、Cl-、 |
D.在c(H+)=1×10-13 mol·L-1的溶液中:Na+、S2-、 、 、 |
设NA表示阿伏加德罗常数,下列叙述正确的是
| A.1 mol AlCl3在熔融状态时离子总数为0.4NA |
| B.标准状况下,2.24L苯中含有的C—H键的数目为0.6NA |
C.2.2g分子式为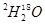 的水中含有的中子数为1.2 NA 的水中含有的中子数为1.2 NA |
| D.电解饱和食盐水时,当阴极产生H222.4L时,电路中转移的电子数为2NA |
已知反应:2NO2(红棕色) N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是

| A.b点的操作是压缩注射器 |
| B.c点与a点相比,c(NO2)增大,c(N2O4)减小 |
| C.若不忽略体系温度变化,且没有能量损失,则T(b)>T(c) |
| D.d 点:v(正)>v(逆) |
下述实验方案不能达到实验目的的是
| 编号 |
A |
B |
C |
D |
| 实验 方案 |
 |
 |
 片刻后在Fe电极附近滴入K3[Fe(CN)6]溶液 |
 2mL0.1mol·L-1NaCl溶液 ① 加入3滴同浓度的AgNO3溶液再加入3滴同浓度的Na2S溶液 |
| 目的 |
验证乙炔的还原性 |
收集氨气 |
验证Fe电极被保护 |
验证AgCl的溶解度 大于Ag2S |