右图为室温下20 mL一定物质的量浓度的盐酸,用一定物质的量浓度的NaOH溶液滴定的图示,据图推出盐酸和NaOH溶液的物质的量浓度(mol·L-1)分别是 ( )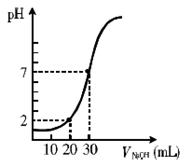
| |
A |
B |
C |
D |
| c(HCl)(mol·L-1) |
0.06 |
0.04 |
0.03 |
0.09 |
| c(NaOH)(mol·L-1) |
0.04 |
0.06 |
0.09 |
0.03 |
常温下,用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如下图。下列说法正确的是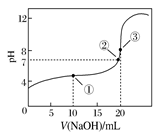
| A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) |
| B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) |
| C.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
| D.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
下列图示与对应的叙述相符的是( )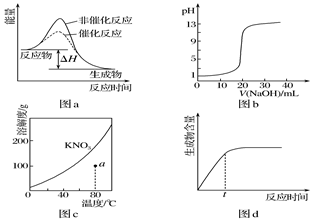
| A.图a表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图b表示0.100 0mol·L-1NaOH溶液滴定20.00mL 0.100 0mol·L-1CH3COOH溶液所得到的滴定曲线 |
| C.图c表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
| D.图d表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大 |
在容积不变的密闭容器中,一定条件下发生反应:2A(?) B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是
B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是
| A.若正反应是吸热反应,则A为非气态 |
| B.若正反应是放热反应,则A为非气态 |
| C.平衡体系中加入少量C,平衡向逆反应方向移动 |
| D.改变压强对该平衡的移动一定无影响 |
已知水的电离方程式:H2O  H+ + OH-。下列叙述中,正确的是
H+ + OH-。下列叙述中,正确的是
| A.升高温度,KW增大,pH不变 |
| B.向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 |
| C.向水中加入少量硫酸,c(H+)增大,KW不变 |
| D.向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低 |
下列说法正确的是:
| A.已知某温度下纯水中的C(H+)=2×l0-7mol/L,据此无法求出水中C(OH-) |
| B.常温,Mg(OH)2能溶于氯化铵浓溶液主要原因是NH4+结合OH-使沉淀溶解平衡发生移动 |
C.已知: 上表数据可以计算出  (g)+3H2(g)→ (g)+3H2(g)→ (g)的焓变 (g)的焓变 |
| D.已知MgCO3的KSP=6.82×l0-6,则在含有固体MgCO3的MgCl2、Na2CO3溶液中,都有c(Mg2+) =c(CO32-),且c(Mg2+)·c(CO32-) = 6.82×10-6 mol2/L2 |