关于下列图示的说法中正确的是A.用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 ( )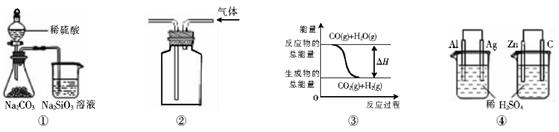
A.用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱
B.用图②所示实验装置排空气法收集CO2气体
C.图③表示可逆反应CO(g)+H2O(g) CO2(g)+H2(g)的△H大于0
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同
在25 ℃、101 kPa时,CH4(g)、H2(g)、C(s)的燃烧热分别是-890.3 kJ·mol-1、-285.8 kJ·mol-1和-393.5 kJ·mol-1,则CH4(g)—→C(s)+2H2(g)的ΔH是
| A.-74.8 kJ·mol-1 | B.+74.8 kJ·mol-1 |
| C.-211.0 kJ·mol-1 | D.+211.0 kJ·mol-1 |
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
| A.12△H3+5△H2-2△H1 | B.2△H1-5△H2-12△H3 |
| C.12△H3-5△H2-2△H1 | D.△H1-5△H2-12△H3 |
已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-57.3 kJ·mol-1,则HCN在水溶液中电离的ΔH等于
| A.-69.4 kJ·mol-1 | B.-45.2 kJ·mol-1 |
| C.+45.2 kJ·mol-1 | D.+69.4 kJ·mol-1 |
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )
| A.a 和 b 不连接时,铁片上会有金属铜析出 |
| B.a 和 b 用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu |
| C.无论 a 和 b 是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 |
| D.a 和 b 分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动 |
室温下,将1.000 mol·L-1盐酸滴入20.00 mL1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )
| A.a点由水电离出的c(H+)=1.0×10-14 mol·L-1 |
| B.b点:c(NH4+)+c(NH3·H2O)=c(Cl-) |
| C.c点:c(Cl-)=c(NH4+) |
| D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 |