有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4)溶解在亚硫酰氯(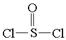 )中形成的,电池总反应方程式为:
)中形成的,电池总反应方程式为:
8Li+3SOCl2=6LiCl+Li2SO3+2S,下列叙述中正确的是
| A.若电解质溶液中混入水,对电池反应无影响 |
| B.金属锂作电池的正极,石墨作电池的负极 |
| C.电池工作过程中,亚硫酰氯(SOCl2)被氧化为Li2SO3 |
| D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:1 |
设NA表示阿伏加德罗常数,下列说法不正确的是
| A.1 mol醋酸的质量与NA个醋酸分子的质量相等 |
| B.NA个氧气分子和NA个氢气分子的质量比等于16∶1 |
| C.30 g乙烷(C2H6)所含的原子数目为NA |
| D.在标准状况下, 0.5NA个氯气分子所占体积约是11.2 L |
下列分散系中最稳定的是
| A.悬浊液 | B.乳浊液 | C.胶体 | D.溶液 |
在盛放酒精的试剂瓶上应印有如下图所示警示标记中的
用4种溶液进行实验,下表中“操作及现象”与“溶液”不符的是
| 选项 |
操作及现象 |
溶液 |
| A |
通入SO2,溶液不变浑浊,再加氯水,变浑浊 |
BaCl2溶液 |
| B |
通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 |
Ca(ClO)2溶液 |
| C |
通入SO2,溶液变浑浊,继续通SO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊 |
Ca(OH)2溶液 |
| D |
通入NH4HCO3受热分解产生的气体,溶液变浑浊,继续通入该气体,浑浊消失 |
Ca(OH)2溶液 |
将镁粉和碳酸镁的混和物置于氧气中灼烧,直至质量不再改变为止,经测定,灼烧后所得的固体质量与原混和物的质量相同,则原混和物中镁粉和碳酸镁的质量比为
| A.4︰7 | B.10︰7 | C.14︰11 | D.11︰14 |