含氮废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属铝将水体中的NO3-还原为N2,从而消除污染。其反应的离子方程式是:
6NO3-+ 10Al + 18H2O=3N2↑+ 10Al(OH)3 + 6OH-。
+ 6OH-。
某化学兴趣小组的同学经过探究发现还有两条途径:
(1)金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同。金属镁是从海水中提取的MgCl2通过电解制得的。若要除去1m3含氮元素0.3mol的废水中的NO3-,则至少需要含0.5%(质量分数)MgCl2的海水多少kg?
(2)甲醇加人含NO3-的废水中也可消除氮的污染,其在一种微生物作用下发生反应:
6NO3- +6H+ +5CH3OH → 3N2↑ + 5CO2 ↑+ 13H2O
若某废水用上述方法处理时, NO3—→N2的 转化率为a%,那么每天处理此含NO3-为b g/L的废水V m3(密度1g/cm3)。需要甲醇多少千克?(要求写出解题步骤,运算过程中的数据及最后结果只需写出运算式,不必化简)
转化率为a%,那么每天处理此含NO3-为b g/L的废水V m3(密度1g/cm3)。需要甲醇多少千克?(要求写出解题步骤,运算过程中的数据及最后结果只需写出运算式,不必化简)
由实验得知用电解法将电解液中的金属离子还原为金属单质时,电极所通过的电荷量Q正比于金属的物质的量n和金属离子化合价a的乘积,Q=F·na,其中F是一恒量,称为法拉第常数,它与金属的种类无关(阿伏加德罗常数NA=6.023×1023 mol-1,电子电荷量e=1.6×10-19 C,Cu的摩尔质量:64×10-3 kg·mol-1)。
(1)试求出法拉第常数F(电荷量以库仑为单位,保留三位有效数字)。
(2)如果电解硫酸铜溶液获得1 kg的金属铜,通过电解槽的电荷量是多少?
(3)用电镀的方法在半径为R的铜球表面均匀地镀上很薄的银层,在电镀槽中铜球是阳极还是阴极?另一电极是什么材料?若电流为I,通电时间为t,银的相对原子质量为A,金属银的密度为ρ,求镀层的厚度d。
两个串联的电解池A和B,分别盛有AgNO3溶液和NaCl溶液,用惰性电极进行电解,当B池的阴极上收集到2.24 L(标准状况)气体时,在A池的阳极上析出物质多少克?若两种溶液都是2 L,两池溶液的pH各是多少?
某实验人员做了下列实验:将一定量1.00mol/L CuSO4溶液和2.00mol/LNaOH溶液混合,得到一种浅绿色沉淀X。将4.54g X隔绝空气在1000℃以上强热,得到一种红色固体Cu2O,质量为2.88g。经分析发现X中含SO42—。试通过计算确定X的化学式。
已知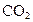 和
和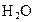 的混合物与
的混合物与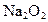 反应时是
反应时是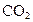 与
与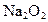 反应完后,
反应完后,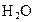 再与
再与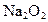 反应.现将a mol的
反应.现将a mol的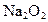 和
和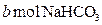 固体混合后,在密闭容器中加热到250℃,让其充分反应,
固体混合后,在密闭容器中加热到250℃,让其充分反应,
(1)当剩余固体为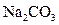 ,排出气体为
,排出气体为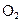 ,
,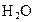 时,
时,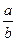 的值为________.
的值为________.
(2)当剩余固体为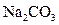 ,NaOH,排出气体为
,NaOH,排出气体为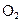 ,
,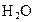 时,
时,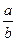 的值为________.
的值为________.
(3)当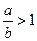 时,剩余固体为________,排出气体为________.
时,剩余固体为________,排出气体为________.
(4)当排出的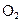 和
和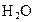 为等物质的量时,则
为等物质的量时,则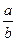 的值为________.
的值为________.
制取4.78kg的普通玻璃(化学式为Na2O·CaO·6SiO2)的同时产生的CO2在标准状况下的体积是多少L?