下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100gl0.00%的K2SO4溶液,电极均为石墨电极。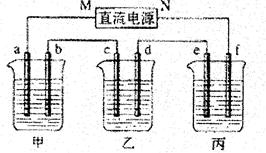
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为 极;
②电极b上发生的电极反应为 ;
③列式计算电极b上生成的气体在标准状况下的体积:  ;
;
④电极c的质量变化是 g;
⑤电解前后个溶液的酸,碱性大小是否发生变化,简述其原因:
甲溶液 ;
乙溶液 ;
丙溶液 ;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填如以下空格内。
(2)反应中,被还原的元素是,还原剂是。
(3)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为。
(本小题共4分)离子反应是中学化学中重要的反应类型。回答下列问题:
(1)离子方程式是重要的化学用语。下列是有关离子反应的一些错误观点,请在下列表格中用相应的一个“离子方程式”否定这些观点。(不能相同)
| ①强酸与强碱发生中和反应均可表示为:H++OH-=H2O |
|
| ②强酸与碱混合一定发生中和反应 |
(4分)写出下列反应的离子方程式:氢氧化钡溶液和硫酸溶液反应
铁与硫酸铜溶液反应
(10分)有下列几组反应:
| A.Zn+2HCl===ZnCl2+H2↑ | B.CO2+H2O===H2CO3 |
| C.S+O2点燃SO2 | D.Ba(OH)2+H2SO4===BaSO4↓+2H2O |
E.Na2CO3+2HCl===2NaCl+H2O+CO2↑ F.CaCO3 CaO+CO2↑
CaO+CO2↑
G.CH4+2O2点燃CO2+H2O H.2KClO3 2KCl+3O2↑
2KCl+3O2↑
以上反应中,属置换反应的是________,属化合反应的是________,属分解反应的是________,属复分解反应的是______,属氧化还原反应的是________。
(4分)鲜榨苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色的Fe2+变为棕黄色的 Fe3+。这个变色的过程中的Fe2+被(填“氧化”或“还原”)。若在榨汁的时候加入适量的维生素C,可有效防止这种现象的发生。这说明维生素C具有:(选择填空)。
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |