下列混合溶液中,各离子浓度的大小顺序正确的是:
| A.10 mL 0.1 mol / L氨水与10 mL 0.1 mol / L盐酸混合, c(Cl-)>c( NH4+)>c(OH-)>c(H+) |
| B.10 mL 0.1 mol / L NH4Cl溶液与5 mL 0.2 mol / L NaOH溶液混合, c(Na+)=c(Cl-)>c(OH-)>c(H+) |
| C.10 mL 0.1 mol / L CH3COOH溶液与5 mL 0.2 mol / L NaOH溶液混合, c(Na+)=c(CH3COO-)>c(OH-)>c(H+) |
| D.10 mL 0.5 mol / L CH3COONa溶液与6 mL 1 mol / L盐酸混合, |
c(Cl-)>c(Na+)>c(OH-)>c(H+)
某反应的反应过程中能量变化如右图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是 ( )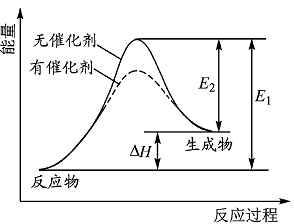
| A.该反应为放热反应 |
| B.催化剂能改变反应的焓变 |
| C.催化剂能降低反应的活化能 |
| D.逆反应的活化能大于正反应的活化能 |
下列元素能形成XY2型化合物的是()
①原子序数分别为6和16的元素,②核内质子数分别为14和8的元素,③外围电子排布式分别是3s2和3s23p5的基态原子,④轨道表示式分别为下图的两种元素的基态原子:
| A.①②③④ | B.只有①②③ | C.只有② | D.只有① |
在原子的第n电子层中,当它属于最外电子层时,最多容纳的电子数目与n-1层相同,当它属于次外层时,最多容纳的电子数比n+1层多10个电子,则此电子层是 ( )
| A.M层 | B.N 层 | C.O层 | D.P层 |
按能量由低到高的顺序排列,正确的一组是 ( )
| A.1s、2p、3d、4s | B.1s、2s、3s、2p | C.2s、2p、3s、3p | D.4p、3d、4s、3p |
据报道,某些建筑材料在使用过程中会产生放射性同位素氡 ,从而对人体产生伤害。该同位素原子的中子数和质子数之差是()
,从而对人体产生伤害。该同位素原子的中子数和质子数之差是()
| A.136 | B.50 | C.86 | D.222 |