化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是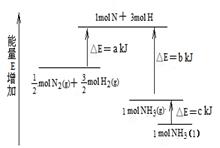
| A.N2(g)+3H2(g)=2NH3(1); △H=2(a-b-c)kJ·mol-1 |
| B.N2(g)+3H2(g)=2NH3(g); △H=2(b-a)kJ·mol-1 |
C. N2(g)+ N2(g)+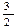 H2(g)=NH3(1); △H=(b+c-a)kJ·mol-1 H2(g)=NH3(1); △H=(b+c-a)kJ·mol-1 |
D.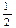 N2(g)+ N2(g)+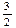 H2(g)=NH3(g); △H=(a+b)kJ·mol-1 H2(g)=NH3(g); △H=(a+b)kJ·mol-1 |
下列物质中只含有离子键的是
| A.SiO2 | B.NaOH | C.MgBr2 | D.HCl |
下列过程一定发生化学变化的是]
| A.焰色反应检验钾元素 | B.石油的分馏 |
| C.氯水久置颜色变浅 | D.用四氯化碳萃取碘水中的碘 |
以节能减排为基础的低碳经济是保持社会可持续发展的战略举措。下列做法符合低碳经济的是
| A.大力推广塑料制品的使用 |
| B.大力发展公共交通,适度控制私家车规模 |
| C.提倡使用一次性生活用品,方便人们生活 |
| D.大量进口石油,满足国内经济发展需求 |
一定量的某有机物完全燃烧后,将燃烧产物通过足量的石灰水,经过滤可得沉淀10g,但称量滤液时,其质量只比原石灰水减少2.9g,则此有机物可能是
| A.乙醇 | B.乙二醇 | C.乙烯 | D.乙醚 |
下图表示在催化剂作用下将X和Y合成具有生物活性的物质Z,W是中间产物(R1、R2均为烃基)。
则下列有关叙述不正确的是
| A.反应①属于加成反应 | B.1molW完全加成需要4molH2 |
| C.X核磁共振氢谱有四个峰 | D.X、Y、W、Z都能与NaOH溶液反应 |