通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的焓变(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 |
H---H |
Cl---Cl |
H---Cl |
| 生成1 mol化学键时所放出的能量(kJ·mol-1) |
436 |
243 |
431 |
则下列热化学方程式不正确的是( )
A.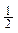 H2(g)+ H2(g)+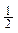 Cl2(g)=HCl (g) ΔH= ﹣91.5 kJ·mol-1 Cl2(g)=HCl (g) ΔH= ﹣91.5 kJ·mol-1 |
| B.H2(g)+ Cl2(g)=2HCl (g) ΔH= ﹣183kJ·mol-1 |
C.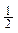 H2(g)+ H2(g)+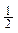 Cl2(g)=HCl (g) ΔH= ﹢91.5 kJ·mol-1 Cl2(g)=HCl (g) ΔH= ﹢91.5 kJ·mol-1 |
| D.2HCl(g)=H2(g)+ Cl2(g) ΔH= ﹢183kJ·mol-1 |
从氧化还原角度分析,下列反应中水的作用相同的是()
① Na和H2O② NO2和H2O③ Cl2和H2O④ Na2O2和H2O
| A.①②③ | B.①②④ | C.①③④ | D.②③④ |
相同温度和压强下,3体积X2气体和6体积Y2气体化合生成6体积气态化合物,则生成物的化学式为
| A.XY | B.X3Y2 | C.X2Y3 | D.XY2 |
食品卫生与人的身体健康关系密切,下列做法会导致食品对人体有害的是
①用乙烯催熟水果;②在沥清公路上翻晒粮食;
③用甲醛浸泡海产品保鲜;④用硫磺薰制粉丝使之变白;
⑤用苏打粉作发酵粉炸油条。
| A.②③④ | B.①③⑤ | C.①②③ | D.①②④ |
生活中遇到下列问题,不涉及化学变化的是
| A.臭氧用于饮水的消毒,医用酒精用于皮肤消毒 |
| B.蜂、蚁蛰咬处涂抹稀氨水可止痒解痛 |
| C.可用热的纯碱溶液去除油污 |
| D.用四氯化碳可擦去圆珠笔油 |
在
 和
和 的混合溶液中,加入足量的
的混合溶液中,加入足量的 的溶液,生成
的溶液,生成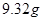 沉淀,再加入足量
沉淀,再加入足量 溶液并加热,生成
溶液并加热,生成 (标准状况),则原溶液中
(标准状况),则原溶液中 的浓度为
的浓度为
A. |
B. |
C.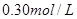 |
D. |