自然界中存在一种尖晶石,化学式为MgAl2O4,它晶莹剔透,非常美观,可以作为宝石。已知该尖晶石中混有一定量的Fe2O3。取该矿石粉末样品11.36 g,恰好能与200 mL一定浓度的盐酸反应,则该盐酸的浓度可能是( )
| A.2.00 mol·L-1 | B.2.80 mol·L-1 |
| C.3.30 mol·L-1 | D.3.50 mol·L-1 |
由长周期元素和短周期元素共同构成的族是①0族 ②主族 ③副族 ④第Ⅷ族
| A.①② | B.①③ | C.②③ | D.③④ |
下列化学用语表示正确的是
| A.乙烯的结构简式:CH2CH2 |
B.甲烷的比例模型: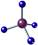 |
C.硫化钾的电子式: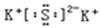 |
| D.CO2的结构式:O—C—O |
科学家发现两种粒子:第一种是只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第二种是由四个氧原子构成的分子。下列有关这两种粒子的说法不正确的是
| A.“四中子”不显电性 |
| B.“四中子”的质量数为4,其质量比氢原子大 |
| C.“零号元素”在元素周期表中与氢元素占同一位置 |
| D.第二种粒子的化学式为O4,与O2互为同素异形体 |
下图是课外活动小组设计的用化学电源使LED灯发光的装置。下列说法错误的是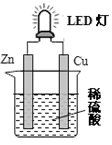
| A.铜片表面有气泡生成 |
| B.装置中存在“化学能→ 电能→ 光能”的转换 |
| C.如果将硫酸换成柠檬汁,导线中不会有电子流动 |
| D.如果将锌片换成铁片,电路中的电流方向不变 |
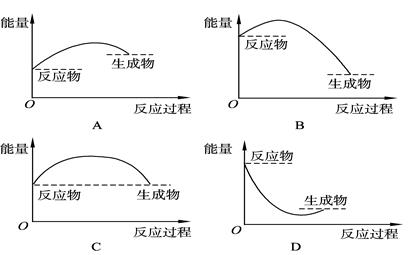
下列表示反应是吸热反应的是