北京2008年奥运会金牌直径为70 mm,厚6 mm。奖牌正面为插上翅膀站立的希腊胜利女神和希腊潘纳辛纳科竞技场。奖牌背面镶嵌着取自中国古代龙纹玉璧造型的玉璧。
(1)环形玉璧由白玉制成。白玉的化学成分可简单看作是Ca2Mg5Si8O22(OH)2,将其改写成氧化物的形式为________________。
(2)为测定金牌的组成,将某去掉白玉的金牌样品,投入到过量稀硝酸中,有无色气体产生,当不再生成气体时,金牌残留一金黄色外壳;将生成的气体与11.2 L O2(标准状况)混合即呈红棕色,最后将其通入水中,所有气体完全被水吸收生成硝酸;再向金牌溶解所得的溶液中滴加氯化钠,立即产生白色沉淀;最后将残壳投入到王水中,随即溶解,生成气体的体积为1.344 L( 标准状况)。已知:Au+HNO3+4HCl===H[AuCl4]+NO↑+2H2O。
标准状况)。已知:Au+HNO3+4HCl===H[AuCl4]+NO↑+2H2O。
①该金牌所含黄金质量为________。
②该金牌除含黄金外还含有另一金属是________(填元素符号),其质量为________。
(3)黄金除能溶于王水外还能溶于氰化钾,反应方程式如下: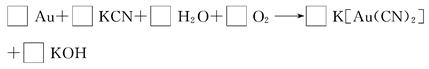
①配平该反应,并将计量数填入方框内。
②K[Au(CN)2]可作为电镀金的电镀液,金牌表面的黄金就是通过电镀镀上的。在电镀金牌时,阴极反应式为________________________________。
(1)填写下表
| 物质(杂质) |
除去杂质 所需试剂或方法 |
离子方程式 (若无离子方程式,则写化学方程式) |
| Fe(Al) |
||
| SiO2(CaCO3) |
||
| CO2(HCl) |
||
| NaHCO3溶液(Na2CO3) |
||
| Na2CO3(NaHCO3) |
||
| Al2O3(Al(OH)3) |
(2)将二氧化硫通入到氯化钡溶液中未见到明显现象,继续通入向该溶液中滴加氯水或氨水,均见到白色沉淀产生,该沉淀的成分分别为或,请分别写出发生反应的离子方程式,。
请完成下列填空:
(1)当SO2和SO3中分子个数比为1∶1 时,原子总数之比为,质量之比为。
(2)中和含0.2 mol HCl的稀盐酸,需NaOH的质量为g。
(3)现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol—1,则:
①该气体的物质的量为mol。
②该气体在标准状况下的体积为L。
③该气体溶于水后形成V L溶液(不考虑反应),其溶液的物质的量浓度为mol·L—1。
(4)将5 mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度是mol·L—1。
(5)用等体积的0.1 mol·L—1的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液中的SO42—完全沉淀,则三种硫酸盐的物质的量浓度之比为。
开发新型储氢材料是氢能利用的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有______个。
②LiBH4由Li+和BH4—构成,BH4—呈正四面体构型。LiBH4中不存在的作用力有______(填标号)。
A.离子键B.共价键C.金属键D.配位键
③Li、B、H元素的电负性由大到小排列顺序为______。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+______H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
M是______(填元素符号)。
(3)某种新型储氢材料的理论结构模型如下图所示,图中虚线框内碳原子的杂化轨道类型有______种。
(4)分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X一定不是______(填标号)。
A.H2OB.CH4C.HF D.CO(NH2)2
硫化钠是重要的工业原料。
(1)高温时,等物质的量甲烷与硫酸钠在催化剂作用下恰好完全反应,制得硫化钠。反应的化学方程式为__________________。
(2)甲同学往某Na2S样品(含Na2CO3、Na2SO4杂质)溶液中加人少量BaS溶液,产生白色沉淀,过滤,向滤渣中加人过量盐酸,沉淀完全溶解。由此得出结论:相同温度下,Ksp(BaCO3)<Ksp(BaSO4)。
①沉淀溶于盐酸的离子方程式是__________________。
②仅由上述实验无法判断Ksp(BaCO3)与Ksp(BaSO4)的大小关系,理由是______。
(3)利用Na2S为沉淀剂由锌灰可制得ZnS。锌灰经稀硫酸浸取后所得浸取液含Zn2+、Cd2+、Al3+、Fe2+, Fe3+等,由该浸取液制备ZnS的工艺流程如下图所示。
①步骤(i)所得滤渣中含有铝元素的物质为______(填化学式)。
②步骤(ii)所加ZnO的作用为____________。
③步骤(iii)中得到Cd单质的离子方程式为____________。
下表是元素周期表的一部分,其中A—G分别代表一种元素。
请根据表中所列元素,回答下列问题:
(1)所列元素中第一电离能最小的是(填元素符号);D元素原子核外有种不同运动状态的电子;基态原子的价电子层中,未成对电子数最多的元素是(填元素符号)。
(2)AC2分子的空间构型是,该分子中A原子的杂化方式为。
(3)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物的溶解度,原因是。
(4)基态G2+的核外电子排布式是,乙二胺(结构简式为H2N—CH2一CH2—NH2)分子中的碳原子的杂化方式为,G2+与乙二胺可形成配离子 该配离子中含有的化学键类型有(填字母编号)。
该配离子中含有的化学键类型有(填字母编号)。
a.配位键 b.极性键 c.离子键 d.非极性键
(5)化合物EF[F(AB)6]是一种常见的蓝笆晶体,其中的AB—与B2为等电子体,则、AB—的电子式为。下图为该蓝色晶体晶胞的 (E+未画出),该蓝色晶体的一个晶胞中E+的个数为个。
(E+未画出),该蓝色晶体的一个晶胞中E+的个数为个。